Содержание
- 2. Положение в ПС химических элементов Д.И. Менделеева 2 период IVА группа, главная подгруппа Z = 6
- 3. Нахождение в природе В воздухе в виде СО2 В земной коре в виде карбонатов (мел, мрамор,
- 4. Аллотропные модификации С Алмаз – прозрачный драгоценный камень, переливающийся всеми цветами радуги Тугоплавкий(4000⁰С и 100 атм.)
- 5. Применение С Алмазы для резки стекла, бурения горных пород, резки сверления металлов и камней, для ювелирных
- 6. Уголь Аморфный углерод, по структуре напоминающий графит, черная твердая пористая масса, сохраняющая структуру исходной древесины Обладает
- 7. Уголь
- 8. Сажа Аморфный углерод, по структуре напоминающий графит, черный, жирный на ощупь порошок Используют при изготовлении резины
- 9. Сажа
- 10. Кокс Аморфный углерод, по структуре напоминающий графит, черный порошок, получаемый при нагревании каменного угля без доступа
- 11. Кокс
- 12. Химические свойства С 1. Горение С + О2 → СО2 + Q уголь загорается на воздухе
- 13. Химические свойства С 4. С оксидами металлов средней активности при t⁰ PbO + C → Pb
- 14. Химические свойства С 6. С водяным паром при t⁰= 800⁰С – газо-паровая конверсия угля – один
- 15. Угарный газ СО Бесцветный ядовитый газ, не имеющий запаха, плохо растворимый в воде, несолеобразующий оксид углерода
- 16. Угарный газ СО Восстанавливает металлы из их оксидов при t⁰ CuO + CO→ Cu + CO2
- 17. Углекислый газ СО2 В лаборатории получают действием соляной кислоты на карбонат кальция (мел, мрамор, известняк) СаСО3
- 18. Углекислый газ СО2 Качественная реакция – помутнение известковой воды Ca(OH)2 + CO2→ CaCO3↓ + H2O Горение
- 19. Углекислый газ СО2 Для тушения пожаров Для производства соды, мочевины Для приготовления газированных напитков «Сухой лед»
- 20. «Сухой лед»
- 22. Скачать презентацию



















 Газовые законы. Расчетные задачи
Газовые законы. Расчетные задачи Photocatalysts based on AgCl / Ag nanocomposites
Photocatalysts based on AgCl / Ag nanocomposites Альдегиды и кетоны
Альдегиды и кетоны Спирты: общая характеристика
Спирты: общая характеристика Материаловедение в полиграфическом и упаковочном производстве
Материаловедение в полиграфическом и упаковочном производстве B13. Задачи на концентрацию и сплавы
B13. Задачи на концентрацию и сплавы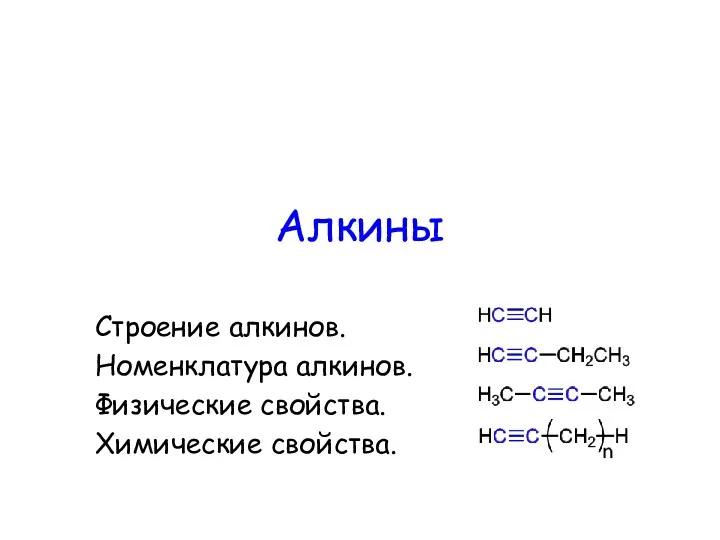 Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства
Алкины. Строение алкинов. Номенклатура алкинов. Физические свойства. Химические свойства Основания
Основания Кислород. Атом кислорода
Кислород. Атом кислорода Простые и сложные эфиры
Простые и сложные эфиры Расчет реактора установки гидроочистки бензина
Расчет реактора установки гидроочистки бензина Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Альдегиды и кетоны
Альдегиды и кетоны Карбоновые кислоты (часть 1)
Карбоновые кислоты (часть 1) Химическая технология органических веществ
Химическая технология органических веществ Сложные эфиры. Жиры
Сложные эфиры. Жиры Атом. Химический элемент. Изотопы. Простые и сложные вещества
Атом. Химический элемент. Изотопы. Простые и сложные вещества Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Биологически важные окислительно-восстановительные реакции органических соединений
Биологически важные окислительно-восстановительные реакции органических соединений Классификация химических реакций
Классификация химических реакций Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда
Анализ качества лекарственных средств органической природы из группы галогенпроизводных углеводородов жирного ряда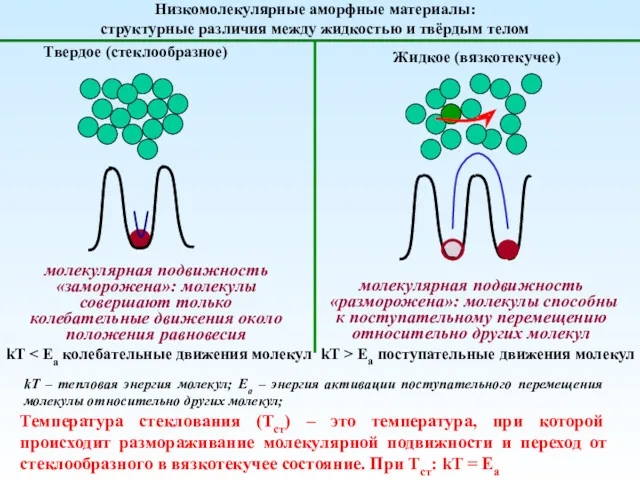 Механика полимеров
Механика полимеров Основные понятия и законы химии. Тема1
Основные понятия и законы химии. Тема1 Механические свойства минералов
Механические свойства минералов Строение атома
Строение атома Геохимия, как наука
Геохимия, как наука Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров
Синтетические моющие средства, порошки, омыление, выпадение в осадок мыла, жиров