Содержание
- 2. Учебные пособия Основные: Козлов В.Д. Введение в геохимию. Издательство ИрГТУ, 2005, 2013. Для дополнительного изучения: Сауков
- 3. Цели и задачи курса Дать представление:
- 4. Геохимия как наука В переводе с греческого термин геохимия означает науку о химии Земли. Впервые этот
- 5. Предпосылки возникновения Открытие периодического закона Д.И.Менделеевым; Синтез минералов и моделирование природных условий минералообразования (В.И.Вернандский, В.М.Гольдшмидт); Создание
- 6. Основоположники геохимии Кларк Франк Уиглсуорт (1847-1931) Американский ученый-химик, заведующий химической лаборатории геологической службы США. Первым начал
- 7. Основоположники геохимии Вернадский Владимир Иванович (1863-1945) Выдающийся русский ученый. Создал генетическую минералогию. Создал геохимию как науку,
- 8. Основоположники геохимии Ферсман Александр Евгеньевич (1883-1945) Выдающийся советский ученый. Выделил главные факторы контролирующие поведение химических элементов
- 9. Основоположники геохимии Гольдшмидт Виктор Мориц (1888-1947) Выдающийся норвежский ученый. Основоположник кристаллохимического и физико-химического направления в геохимии.
- 10. цели и задачи геохимии «…Главная задача геохимии – изучение количественного состава планеты…». Кларк Ф.У. «…Важная задача
- 11. Определение состава геологических оболочек Земли и слагающих ее геологических объектов. Изучение причин и закономерностей миграции атомов
- 12. Разделы геохимии Для изучения различных оболочек Земли и протекающих в них процессах выделяются: Атмогеохимия – изучает
- 13. Образование и распространенность химических элементов «…Геохимия изучает историю химических элементов – атомов в земной коре и
- 14. Гипотеза большого взрыва Согласно гипотезе, зарождение всей Вселенной было связано с Большим Взрывом (БВ), 12,5-14 миллиардов
- 15. Пылево-газовая туманность Потенциальные источники вещества для образования звездных систем
- 16. Вселенная Вселенная состоит из множества галактик, триллионов отдельных звезд. Первоначальный радиус Вселенной оценивается в 15 млн.
- 17. Строение атомных ядер Согласно современным представлениям квантовой физики атом имеет «гелиоцентрическое» строение. В центре атома расположено
- 18. Открытие Г. Мозли В 1913г. английский физик Г. Мозли ввел термин атомный номер химического элемента. Заряды
- 19. Изотопы В ядре атома протоны и нейтроны связаны соотношением: A = Z + N А –
- 20. Изотопы Следовательно, изотопы одного элемента, обладая одинаковыми зарядом ядра, различаются их атомными весами. 15О - 8
- 21. Происхождение химических элементов Во время большого взрыва были образованы только атомы водорода и гелия. Остальные элементы
- 22. Возможные ядерные реакции в зависимости от массы звезды (М = Звезда/Солнце) Масса звезды определяет величину гравитационных
- 23. Синтез дейтерия – начало термоядерных реакций Протозвезда (Т = 100 000 К) Дейтерий – изотоп водорода
- 24. Горение водорода Звезда (Т = 1 000 000О К) 12C+1H → 13N → 13C + e+
- 25. Дефект массы Реальная масса изотопов всегда несколько меньше, чем если их составлять из атомов водорода. Эта
- 26. Горение гелия Звезда (Т = 100 000 000О К) 34He → 12C; 12C + 4He →
- 27. Термоядерные реакции ответственные за образование атомов элементов
- 29. Скачать презентацию
 Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Електронна будова оболонок атомів. Принцип мінімальної енергії
Електронна будова оболонок атомів. Принцип мінімальної енергії Степень окисления. Составление химических формул бинарных соединений. 8 класс
Степень окисления. Составление химических формул бинарных соединений. 8 класс Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения
Деятельность лабораторий контроля химических факторов. Внедрение политики импортозамещения Кинетическое уравнение математическая запись закона действующих масс
Кинетическое уравнение математическая запись закона действующих масс Алкены, алкины, диены
Алкены, алкины, диены Химия. 8 класс. Введение в химию
Химия. 8 класс. Введение в химию Презентация по химии по теме Решаем задачи Домашняя аптечка для 8, 9 класса
Презентация по химии по теме Решаем задачи Домашняя аптечка для 8, 9 класса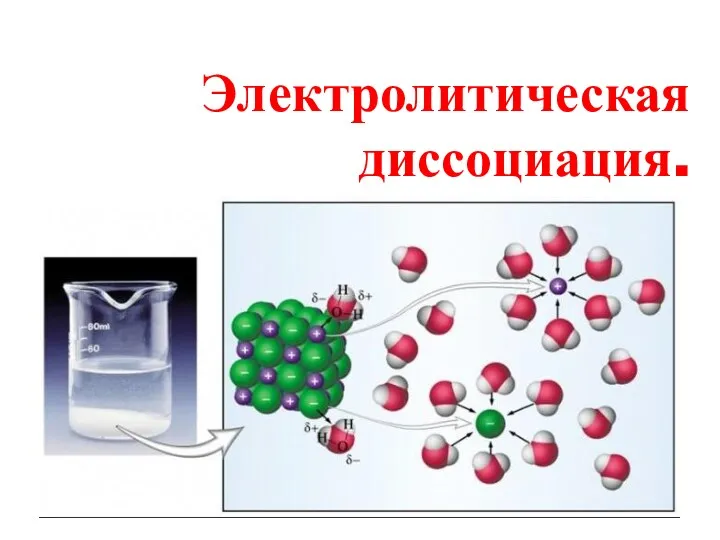 Электролитическая диссоциация
Электролитическая диссоциация Разработка и добыча нефти и газа. (Тема 1.5)
Разработка и добыча нефти и газа. (Тема 1.5) Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Основания, их классификация и свойства
Основания, их классификация и свойства Нефть. Состав. Свойства. Переработка
Нефть. Состав. Свойства. Переработка Химическая связь
Химическая связь Углекислый газ
Углекислый газ Теория электролитической диссоциации
Теория электролитической диссоциации Нефть и способы ее переработки. (10 класс)
Нефть и способы ее переработки. (10 класс) Относительные атомные и молекулярные массы
Относительные атомные и молекулярные массы Вода. Химические свойства воды. Состав, нахождение в природе
Вода. Химические свойства воды. Состав, нахождение в природе Щелочи
Щелочи Металлы. Особенности строения. Классификация, физические и химические свойства
Металлы. Особенности строения. Классификация, физические и химические свойства Химические свойства водорода
Химические свойства водорода Aqueous Solutions of Electrolytes
Aqueous Solutions of Electrolytes Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Полимеры. Полимерные материалы
Полимеры. Полимерные материалы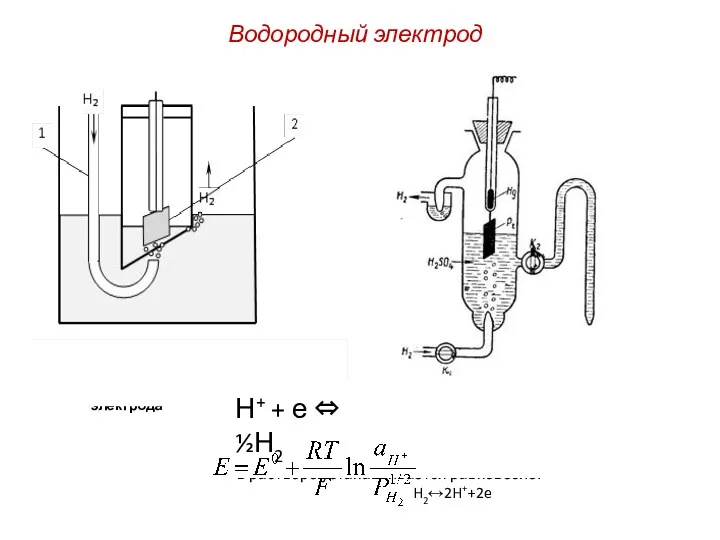 Водородный электрод
Водородный электрод Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас
Розрахункові задачі. Розрахунки за хімічними рівняннями маси, об’єму, кількості речовини реагентів та продуктів. Хімія. 8 клас Аррениус Сванте Август
Аррениус Сванте Август