Содержание
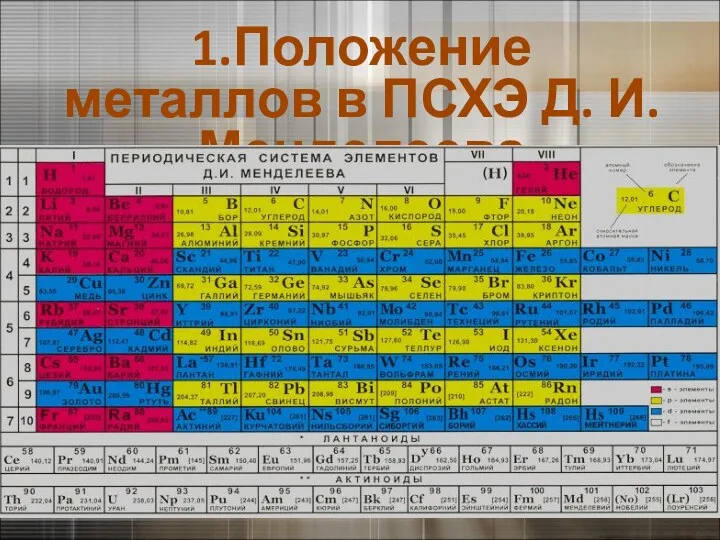
- 2. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 3. 1.Положение металлов в ПСХЭ Д. И. Менделеева
- 4. В группах: металлические свойства усиливаются причина: 1.увеличивается заряд ядра, 2.число электронов на внешнем уровне не изменяется
- 5. 1.Положение металлов в ПСХЭ Д. И. Менделеева К элементам - металлам относятся: s - элементы I
- 6. 2.Строение атомов металлов и веществ металлов Из положения в таблице Д.И. Менделеева следует: Атомы металлов на
- 7. 2. У атомов металлов большие размеры атомных радиусов. Поэтому металлы легко отдают внешние электроны. Металлы в
- 8. Металлическая связь – это связь в металлах и сплавах между атом-ионами металлов, расположенными в узлах кристаллической
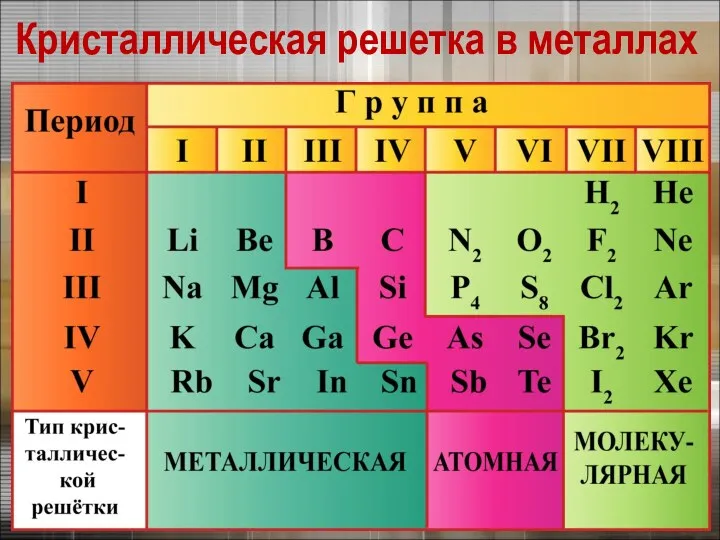
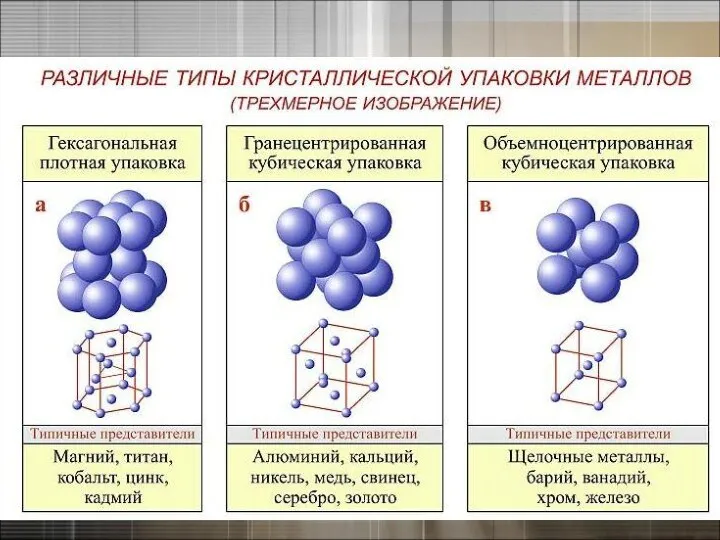
- 9. Кристаллическая решетка в металлах
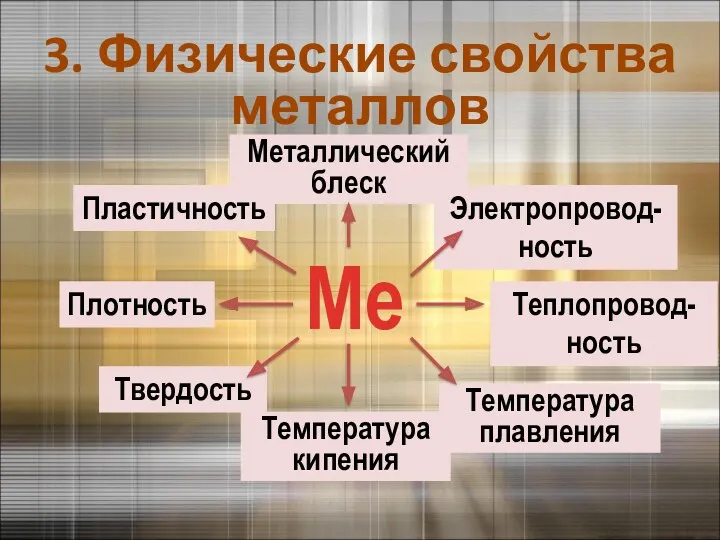
- 12. Температура плавления Ме Металлический блеск Теплопровод-ность Электропровод-ность Температура кипения Твердость Плотность Пластичность 3. Физические свойства металлов
- 13. 3. Физические свойства металлов 1. Металлический блеск Самые блестящие металлы – Hg, Ag, Pd. В порошке
- 15. 3. Физические свойства металлов Наименьшая электропроводность в ряду: Mn → Pb → Hg. В ряду: Ag→Cu
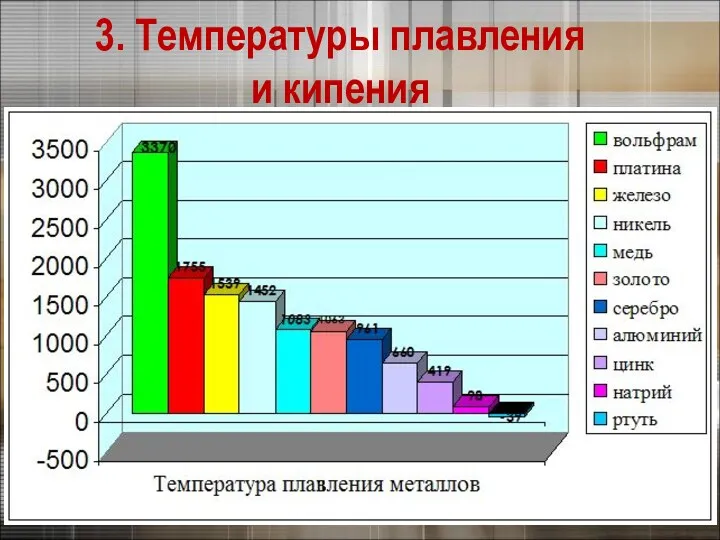
- 17. 3. Физические свойства металлов 3. Температуры плавления и кипения Калий Вольфрам Ртуть
- 18. 3. Температуры плавления и кипения
- 19. 3. Физические свойства металлов 3. Температуры плавления и кипения Самый легкоплавкий металл – ртуть (т.пл. =
- 20. Нить накаливания
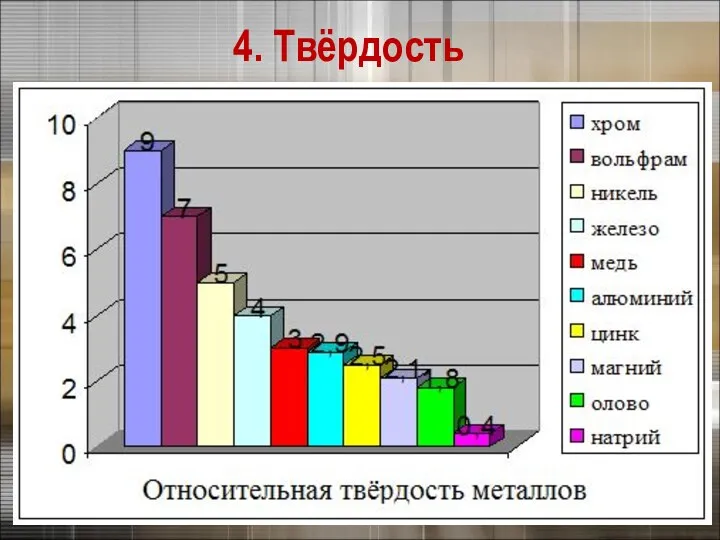
- 21. 3. Физические свойства металлов 4. Твёрдость Щелочные металлы режутся ножом
- 22. 4. Твёрдость
- 23. Хром – самый твёрдый металл
- 24. 4. Твёрдость Самый твердый – хром (режет стекло). Самые мягкие – щелочные металлы – калий, натрий,
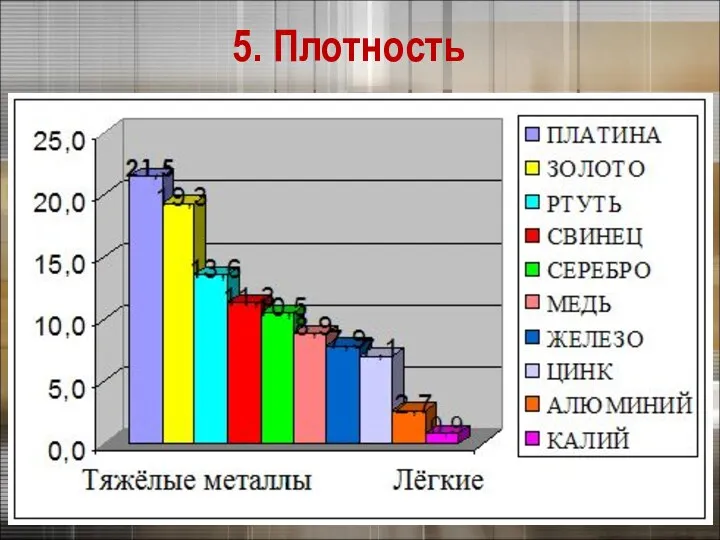
- 25. Плотность тем меньше, чем меньше атомная масса металла и чем больше радиус его атома 5. Плотность
- 26. 5. Плотность
- 27. Самый легкий – литий (ρ =0,53 г/см3), всплывает в керосине. Самый тяжелый – осмий (ρ =22,6
- 28. Литий – самый лёгкий металл
- 29. Осмий – самый тяжёлый металл Осмий – самый дорогой металл (изотоп 187)
- 30. 6. Пластичность Пластичность - способность изменять форму при ударе, вытягиваться в проволоку, прокатываться в тонкие листы.
- 31. Сусальное золото
- 32. Ряд активности металлов последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов Увеличение
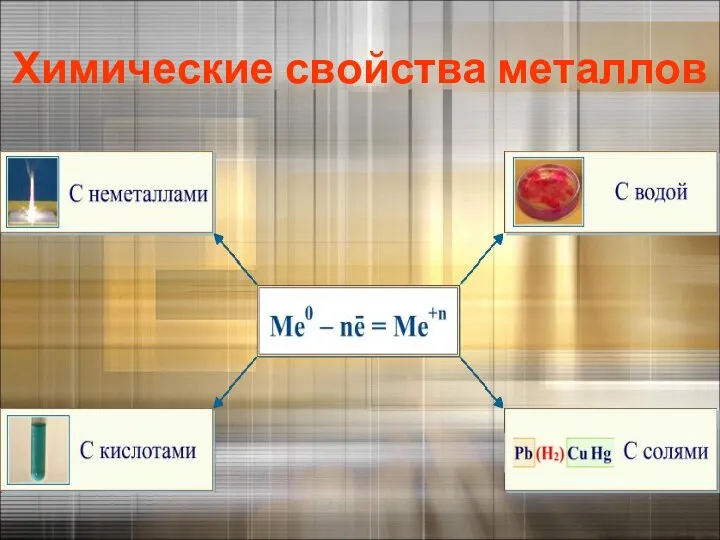
- 34. Химические свойства металлов
- 35. Взаимодействие с неметаллами: с кислородом ( опыт)
- 36. Взаимодействие со сложными веществами: с водой (опыт)
- 37. Взаимодействие растворами кислот(опыт)
- 38. Взаимодействие с растворами солей (опыт) «Каждый металл вытесняет из растворов солей другие металлы, находящиеся правее него
- 40. Какие реакции практически осуществимы?
- 41. 1.Zn+2HCl→ 2.Сu+HCl→ 3.Fe+CuSO4→ 4.Cu+FeCl2→ 5.Cu+O2→
- 42. Выводы : Все металлы имеют --------------- кристаллическую решетку. В металлах осуществляется --------------------- связь. Основные физические свойства
- 43. РЕФЛЕКСИЯ 1. Вам было легко или были трудности? 2. Какое задание было самым интересным и почему?
- 45. Скачать презентацию


































 Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады)
Решение задач в химии (ОГЭ, ЕГЭ, Олимпиады) Катализаторы. Ферменты
Катализаторы. Ферменты Электролитическая диссоциация веществ
Электролитическая диссоциация веществ Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Галогены. Расположите галогены в порядке их открытия
Галогены. Расположите галогены в порядке их открытия Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота
Сероводород, Сульфиды. Оксид серы (IV). Сернистая кислота Реакции при нагревании
Реакции при нагревании Природные источники углеводородов
Природные источники углеводородов Суды тазарту әдістері
Суды тазарту әдістері Алюминий. Сплавы алюминия
Алюминий. Сплавы алюминия Молярный объем. Закон Авогадро
Молярный объем. Закон Авогадро Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды
Силикаты (класс). Подкласс филлосиликаты (слоистые/листовые силикаты). Семейство слюды Вода и здоровье
Вода и здоровье Атмосфера. Химия стратосферы
Атмосфера. Химия стратосферы Углерод. Аллотропные модификации
Углерод. Аллотропные модификации Сплав золота и серебра - электрум
Сплав золота и серебра - электрум Алкени та алкіни
Алкени та алкіни Комплексні сполуки
Комплексні сполуки Марганец и его соединения
Марганец и его соединения Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Свойства простых веществ в свете ОВР
Свойства простых веществ в свете ОВР Углеводы (сахариды)
Углеводы (сахариды) Простые и сложные вещества. Химический элемент
Простые и сложные вещества. Химический элемент Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Кислородные соединения азота
Кислородные соединения азота Химические свойста воды
Химические свойста воды Химическое равновесие
Химическое равновесие