Содержание
- 2. НАХОЖДЕНИЕ В ТАБЛИЦЕ МЕНДЕЛЕЕВА Углерод Carbogenium - 6ой элемент в таблице Менделеева. Он располагается в главной
- 3. НАХОЖДЕНИЕ В ПРИРОДЕ В настоящее время известно более миллиона соединений углерода с другими элементами. Их изучение
- 4. НАХОЖДЕНИЕ В ПРИРОДЕ Углерод занимает 17-е место по распространенности в земной коре – 0,048%. Но несмотря
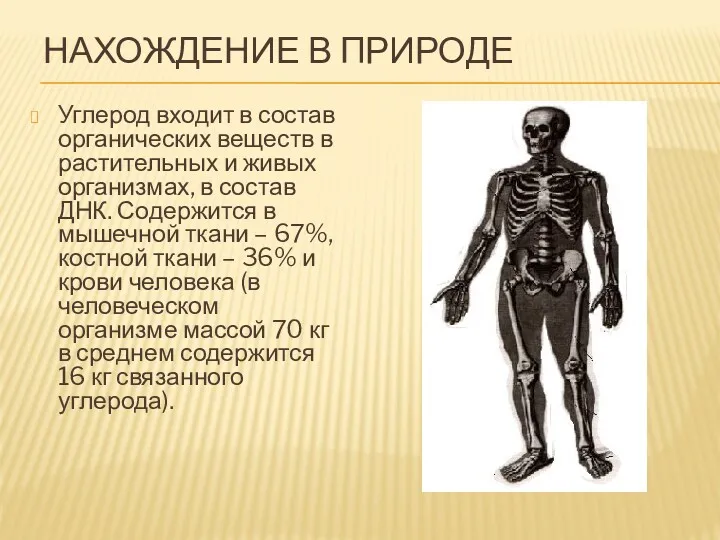
- 5. НАХОЖДЕНИЕ В ПРИРОДЕ Углерод входит в состав органических веществ в растительных и живых организмах, в состав
- 6. СВОБОДНЫЙ УГЛЕРОД В свободном виде углерод встречается в нескольких аллотропных модификациях – алмаз, графит, карбин, крайне
- 7. АЛМАЗ
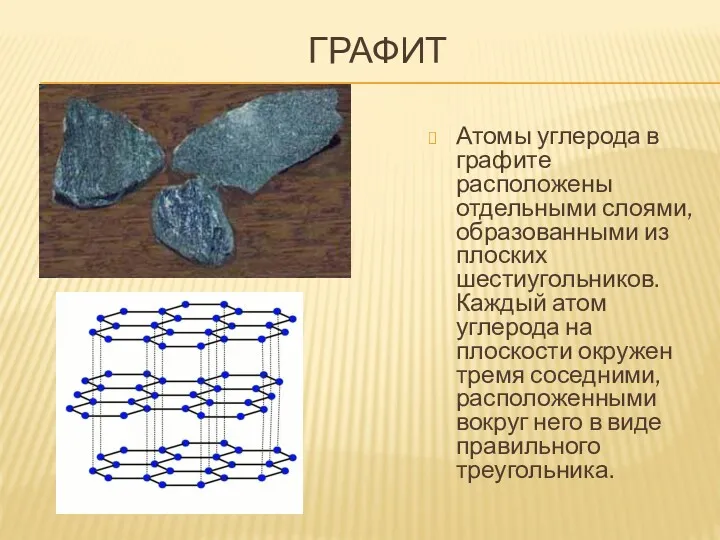
- 8. ГРАФИТ
- 9. МОДЕЛЬ ФУЛЛЕРЕНА С60
- 10. АЛМАЗ Алмаз – бесцветное, прозрачное, сильно преломляющее свет вещество. Алмаз тверже всех найденных в природе веществ,
- 11. АЛМАЗ Плотность алмаза – 3,5 г/см3, tплав=3730С, tкип=4830оС. Алмаз можно получить из графита при p >
- 12. АЛМАЗ Непрерывная трехмерная сетка ковалентных связей, которая характеризуется большой прочностью, определяет многие свойства алмаза, так то
- 13. ГРАФИТ Графит – устойчивая при нормальных условиях аллотропная модификация углерода, имеет серо-черный цвет и металлический блеск,
- 14. ГРАФИТ Атомы углерода в графите расположены отдельными слоями, образованными из плоских шестиугольников. Каждый атом углерода на
- 15. ГРАФИТ Графит характеризуется меньшей плотностью и твердостью, а также графит может расщепляться на тонкие чешуйки. Чешуйки
- 16. КАРБИН Карбин был получен в начале 60-х годов В.В. Коршаком, А.М. Сладковым, В.И. Касаточкиным, Ю.П. Кудрявцевым.
- 17. КАРБИН Он имеет вид черного мелкокристаллическ-ого порошка, однако может существовать в виде белого вещества с промежуточной
- 18. КАРБИН За счет существования различных типов связи и разных способов укладки цепей из углеродных атомов в
- 19. КАРБИН Карбин уже нашел применение в электронике, космонавтике, авиации и медицине. Перспективно его применение в оптике,
- 20. ДРУГИЕ ФОРМЫ УГЛЕРОДА Известны и другие формы углерода, такие как уголь, кокс и сажа. Но все
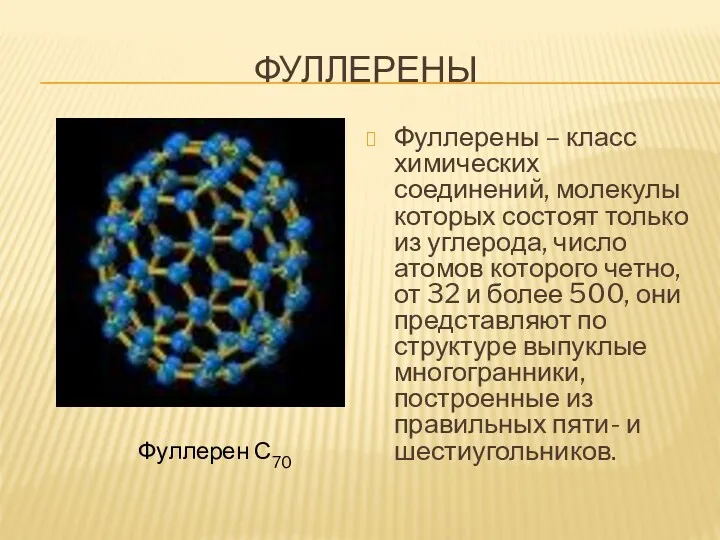
- 21. ФУЛЛЕРЕНЫ Фуллерены – класс химических соединений, молекулы которых состоят только из углерода, число атомов которого четно,
- 22. ФУЛЛЕРЕНЫ Происхождение термина "фуллерен" связано с именем американского архитектора Ричарда Букминстера Фуллера, конструировавшего полусферические архитектурные конструкции,
- 23. ФУЛЛЕРЕНЫ В противоположность первым двум, графиту и алмазу, структура которых представляет собой периодическую решетку атомов, третья
- 24. ФУЛЛЕРЕНЫ Молекулы фуллеренов, в которых атомы углерода связаны между собой как одинарными, так и двойными связями,
- 26. Скачать презентацию




















 Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) Кислородсодержащие соединения. Ароматические соединения
Кислородсодержащие соединения. Ароматические соединения Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Электрохимическая коррозии. Катодные процессы электрохимической коррозии
Электрохимическая коррозии. Катодные процессы электрохимической коррозии Типы химических соединений, номенклатура, свойства
Типы химических соединений, номенклатура, свойства Водород. Положение в периодической системе
Водород. Положение в периодической системе Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Группа веществ, изолируемых из биологического материала дистилляцией
Группа веществ, изолируемых из биологического материала дистилляцией Коррозия металлов. Классификация коррозионных процессов
Коррозия металлов. Классификация коррозионных процессов Complex compounds
Complex compounds Углеводороды. Применение природных источников углеводородов и продуктов их переработки
Углеводороды. Применение природных источников углеводородов и продуктов их переработки Водород. Получение и свойства водорода
Водород. Получение и свойства водорода Основи. Гідроксиди Натрію і Кальцію
Основи. Гідроксиди Натрію і Кальцію Неметаллы. Уменьшение радиусов атомов
Неметаллы. Уменьшение радиусов атомов Альдегиды и кетоны
Альдегиды и кетоны Характеристика строения и свойств химических элементов
Характеристика строения и свойств химических элементов Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов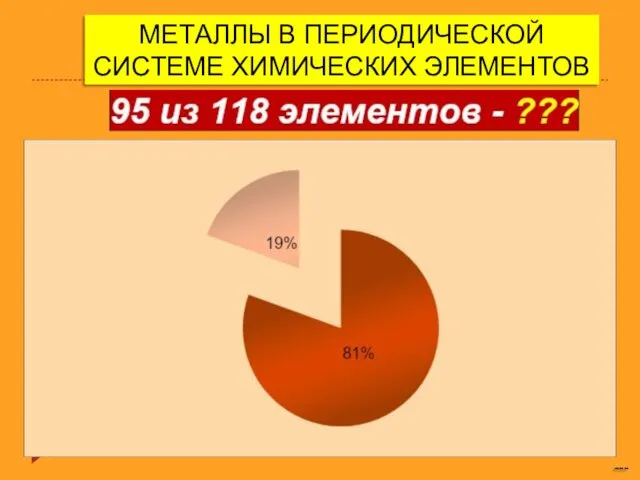 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Объёмная доля компонента смеси
Объёмная доля компонента смеси Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Законы химии. Классы неорганических соединений
Законы химии. Классы неорганических соединений Трансформация энергии в процессе оксигенного фотосинтеза
Трансформация энергии в процессе оксигенного фотосинтеза Горение топлива
Горение топлива Строение атома. Лекция 2
Строение атома. Лекция 2 Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева
Щелочные металлы. Периодическая система химических элементов Д.И. Менделеева Композиты на основе полибензоксазинов
Композиты на основе полибензоксазинов Оксиды. Названия оксидов
Оксиды. Названия оксидов