Стандартный потенциал электрода E0 – это ЭДС системы, составленной из этого
электрода в стандартных условиях (aox = ared = 1, t = 25 °C) и стандартного водородного электрода.
Стандартный потенциал зависит от природы электрода и природы растворителя.
Стандартные потенциалы в водородной шкале для многих электродов сведены в таблицы и широко используются в электрохимии.
Использование таблицы стандартных потенциалов:
Для расчета равновесного потенциала по уравнению Нернста.
Например, для цинкового электрода:
Стандартные электродные потенциалы и их практическое значение









 Химия в повседневной жизни человека
Химия в повседневной жизни человека Карбонові кислоти
Карбонові кислоти Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Молекулярные свойства жидкостей
Молекулярные свойства жидкостей Массовая доля вещества в растворе. 8 класс
Массовая доля вещества в растворе. 8 класс История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами
История развития контролируемой радикальной полимеризации. Управление ростом полимерной цепи нитроксильными радикалами Основные понятия и законы химии
Основные понятия и законы химии Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Кислородные соединения серы. Серная кислота
Кислородные соединения серы. Серная кислота Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация)
Методы разделения и очистки биомолекул. Ультрацентрифугирование (седиментация) Методика “Кольоропис”
Методика “Кольоропис” Аминокислоты. АТФ
Аминокислоты. АТФ Серная кислота и её свойства
Серная кислота и её свойства Механическая смесь и растворы
Механическая смесь и растворы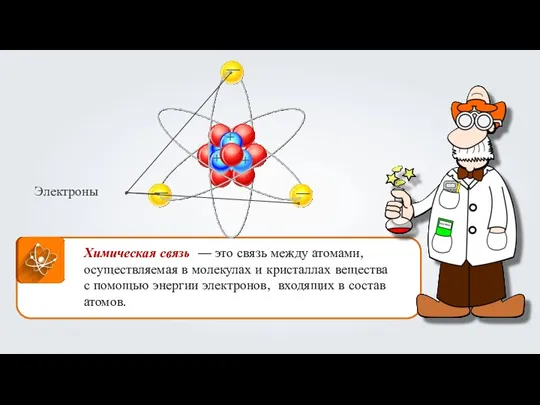 Химическая связь
Химическая связь Галогены. 9 класс
Галогены. 9 класс Взаимное влияние атомов в молекулах. Шкалы электроотрицательности
Взаимное влияние атомов в молекулах. Шкалы электроотрицательности Биохимия. Лекция 7. Углеводы
Биохимия. Лекция 7. Углеводы Хроматография. Классификации хроматографических методов
Хроматография. Классификации хроматографических методов Алюминий и его соединения
Алюминий и его соединения Практическая работа №2. Наблюдение за горящей свечой
Практическая работа №2. Наблюдение за горящей свечой Галогены (солеобразующие)
Галогены (солеобразующие) Алюминий и его соединения
Алюминий и его соединения Простые и сложные вещества
Простые и сложные вещества Химические элементы в космосе. Космогеохимия
Химические элементы в космосе. Космогеохимия Простые вещества металлы
Простые вещества металлы Полисахариды. Крахмал Целлюлоза. 10 класс
Полисахариды. Крахмал Целлюлоза. 10 класс