Содержание
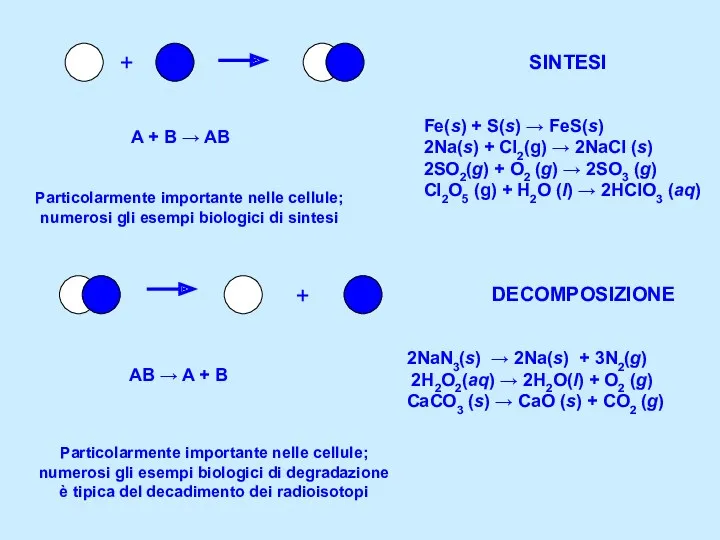
- 2. SINTESI A + B → AB Fe(s) + S(s) → FeS(s) 2Na(s) + Cl2(g) → 2NaCl
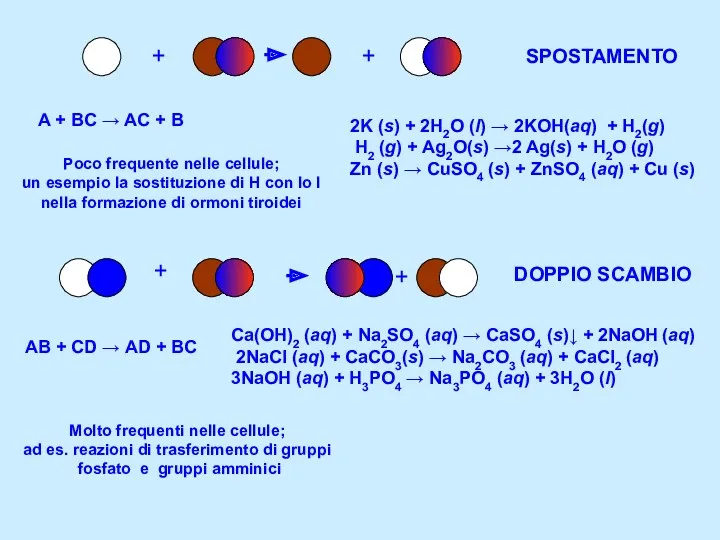
- 3. SPOSTAMENTO 2K (s) + 2H2O (l) → 2KOH(aq) + H2(g) H2 (g) + Ag2O(s) →2 Ag(s)
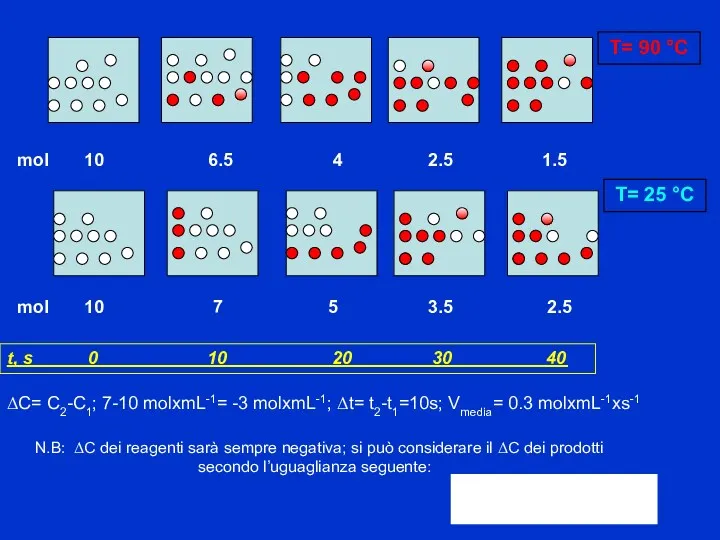
- 4. ΔC= C2-C1; 7-10 molxmL-1= -3 molxmL-1; Δt= t2-t1=10s; Vmedia= 0.3 molxmL-1xs-1 N.B: ΔC dei reagenti sarà
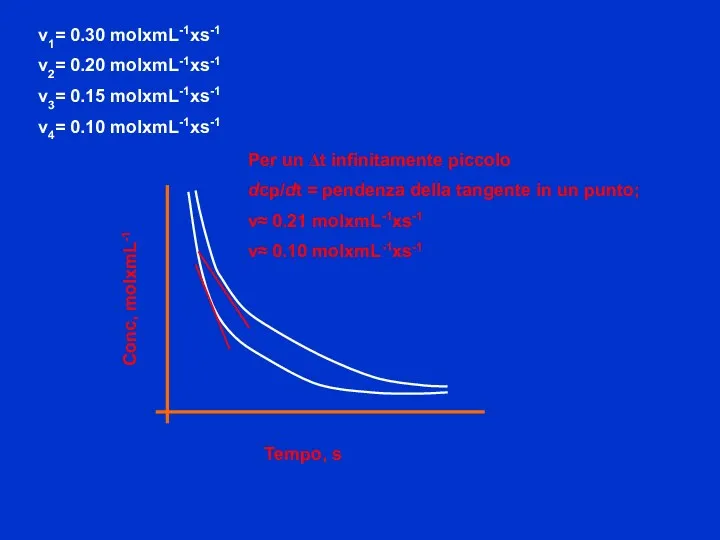
- 5. Per un Δt infinitamente piccolo dcp/dt = pendenza della tangente in un punto; v≈ 0.21 molxmL-1xs-1
- 6. Velocita dipende dalla concentrazione di uno o più dei reagenti V=k1Cr (1) k1= costante di velocità;
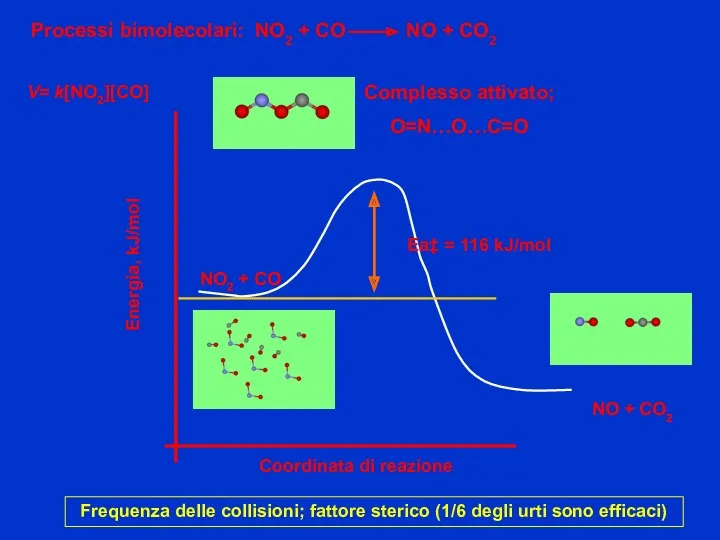
- 7. V= k[O2]x[NO]2
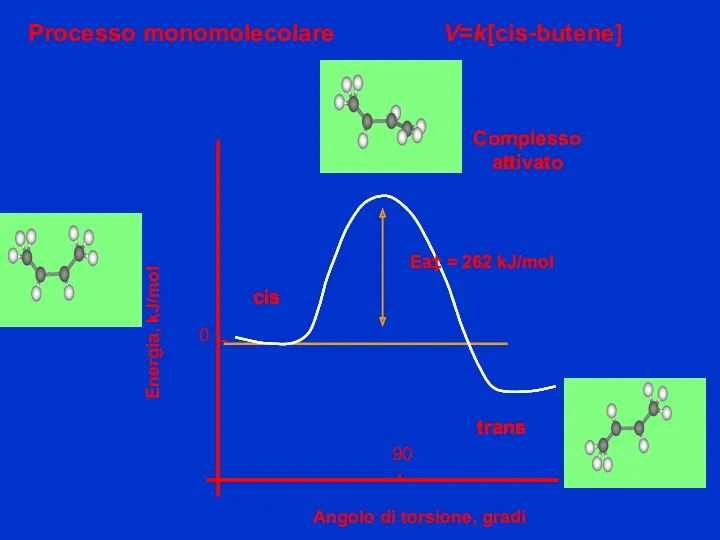
- 8. Energia, kJ/mol Angolo di torsione, gradi 90 0 Processo monomolecolare cis trans Ea‡ = 262 kJ/mol
- 11. CINETICA studia la velocità e il meccanismo di una reazione chimica TERMODINAMICA studia i cambiamenti energetici
- 12. Ordine di reazione conc tempo prodotti reagenti V= k[reagenti] 0; indipendente dalla concentrazione dei reagenti; A→B;
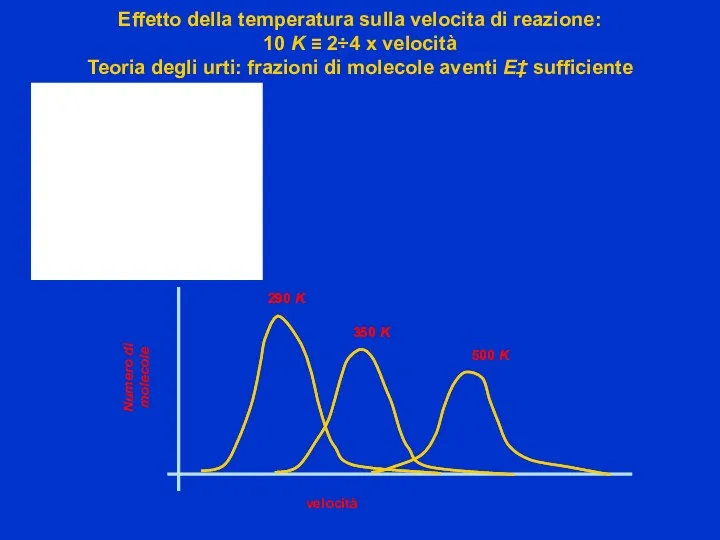
- 13. Numero di molecole velocità Effetto della temperatura sulla velocita di reazione: 10 K ≡ 2÷4 x
- 14. Relazione e grafico di Arrhenius Logk, s-1 1/T, K-1
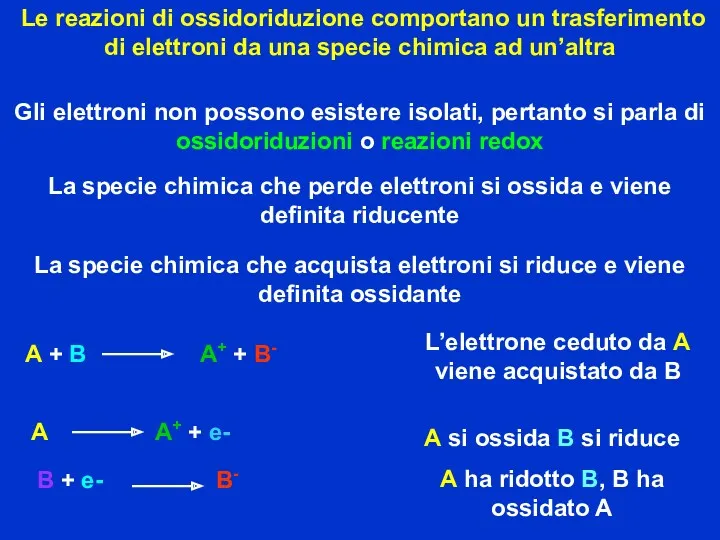
- 15. REAZIONI DI OSSIDORIDUZIONE Le reazioni di ossidoriduzione comportano un trasferimento di elettroni da una specie chimica
- 16. La specie chimica che perde elettroni si ossida e viene definita riducente Le reazioni di ossidoriduzione
- 17. Il potere ossidante di una specie chimica viene identificato dal potenziale di riduzione standard (E0) che
- 18. Quanto più negativo è E0 tanto maggiore è il potere riducente I potenziali standard delle specie
- 19. Potenziali di riduzioni standard di alcuni composti biologici (E0’ 25°C, pH 7.0) Gli elettroni fluiscono spontaneamente
- 20. Gli elettroni possono essere trasferiti da una specie chimica all’altra in diversi modi REAZIONI DI OSSIDORIDUZIONE
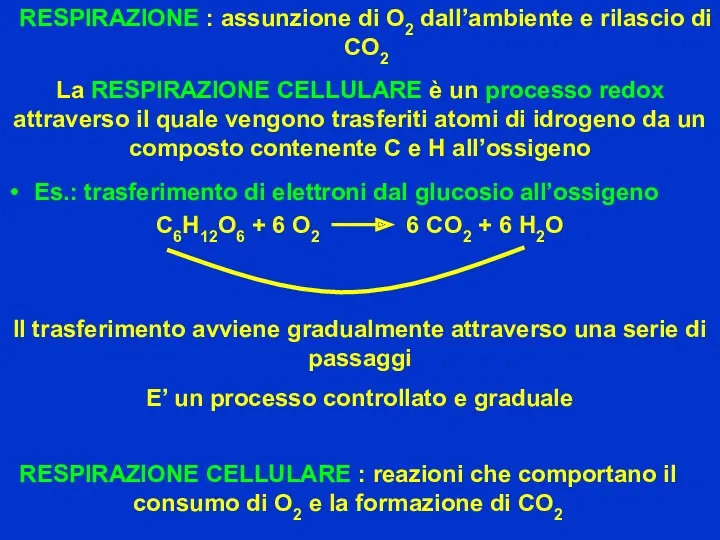
- 21. RESPIRAZIONE : assunzione di O2 dall’ambiente e rilascio di CO2 RESPIRAZIONE CELLULARE : reazioni che comportano
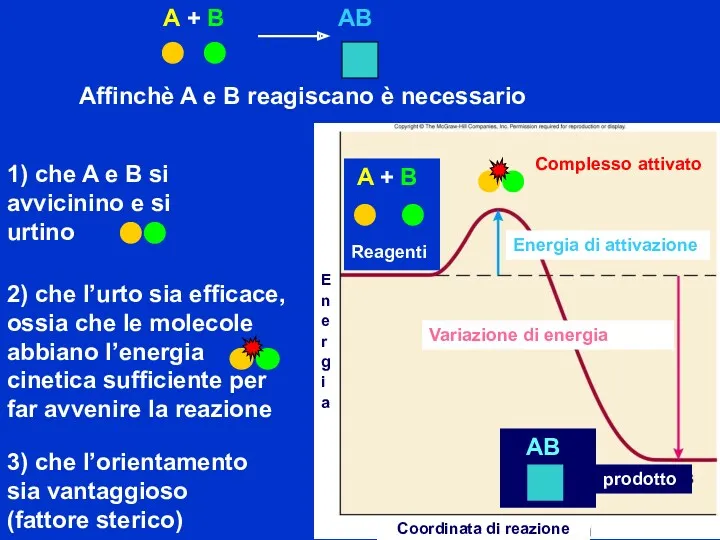
- 22. Quando due o più specie chimiche reagiscono tra loro per formare altre specie chimiche lo fanno
- 23. Le reazioni chimiche sono governate dai principi della conservazione Legge della conservazione di massa: durante una
- 24. Ad ogni reazione è associata una variazione di energia
- 25. CINETICA studia la velocità e il meccanismo di una reazione chimica TERMODINAMICA studia i cambiamenti energetici
- 26. Le variazioni di energia che accompagnano una reazione chimica sono definite dalle 3 grandezze termodinamiche. Entalpia
- 27. Le variazioni di energia libera, di entalpia e di entropia sono tra loro correlate ΔG =
- 28. Le variazioni di energia libera, di entalpia e di entropia sono tra loro correlate ΔG =
- 29. I Legge della termodinamica (conservazione dell’energia) La quantità totale di energia dell’Universo (sistema isolato) rimane costante:
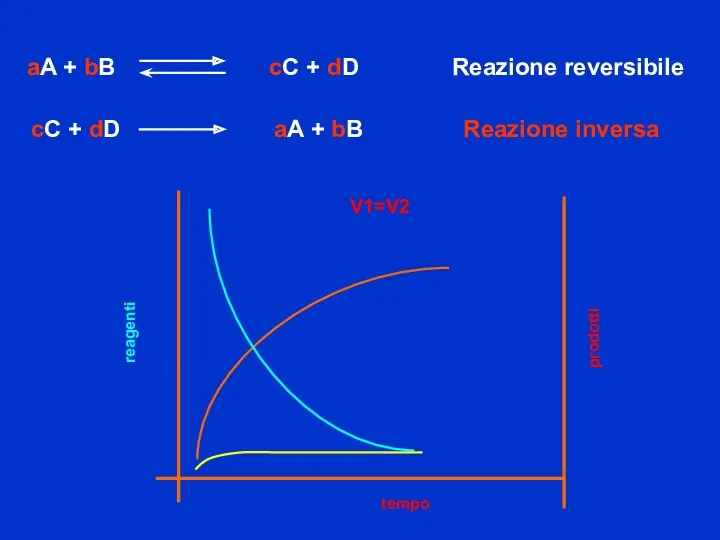
- 30. REAZIONI IRREVERSIBILI REAZIONI REVERSIBILI Velocità reazione diretta v1 = k1 [A]a[B]b Velocità reazione inversa v2 =
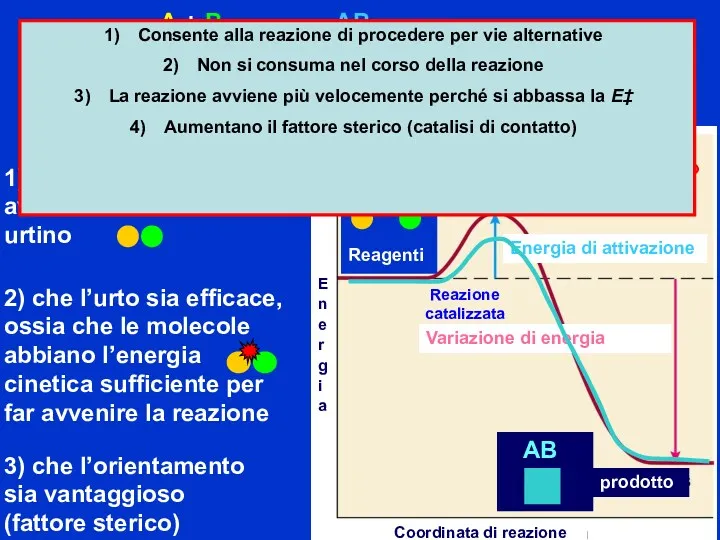
- 31. Reazione catalizzata Consente alla reazione di procedere per vie alternative Non si consuma nel corso della
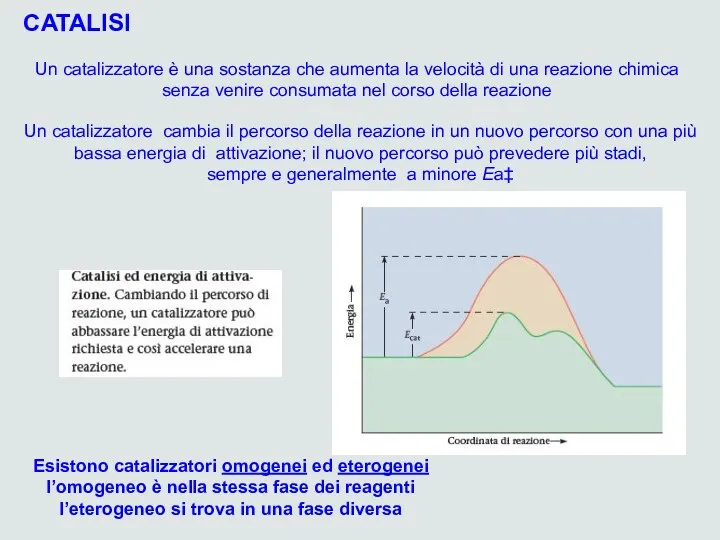
- 32. Un catalizzatore è una sostanza che aumenta la velocità di una reazione chimica senza venire consumata
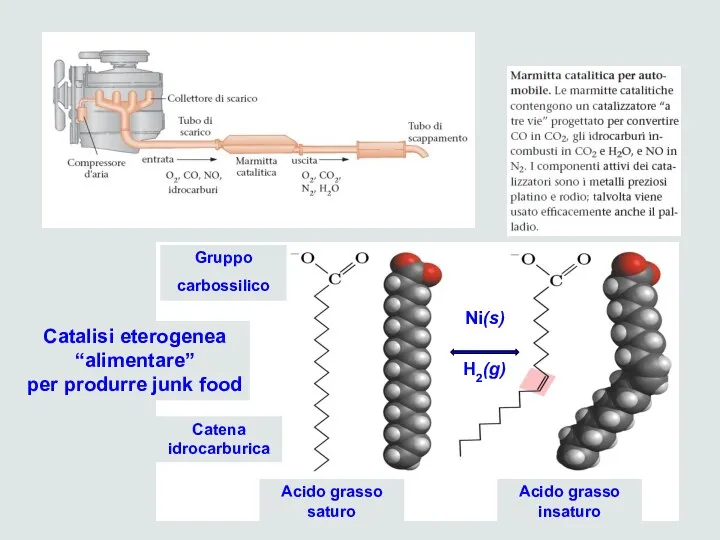
- 33. Catalisi eterogenea Un solido può fare aumentare la velocità di una reazione in fase gassosa Catalisi
- 34. Ni(s) H2(g) Catalisi eterogenea “alimentare” per produrre junk food
- 35. Catalisi omogenea è nella stessa fase dei reagenti questa reazione è molto lenta; può essere accelerata
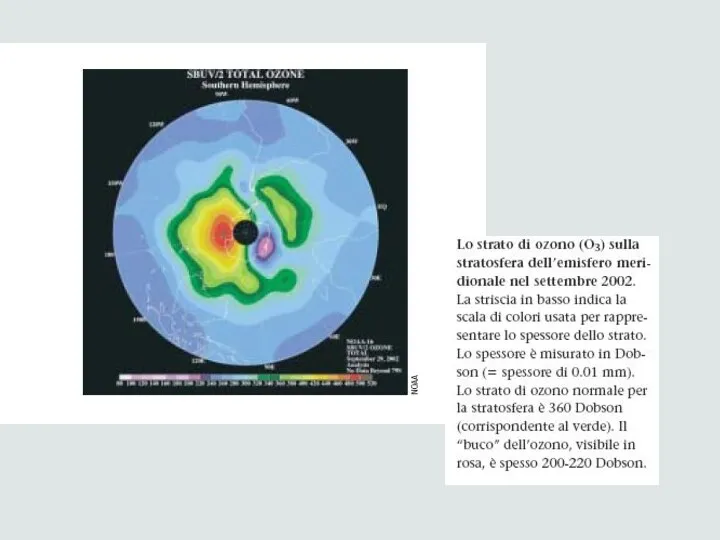
- 36. L’ozono Formula molecolare O3, blu pallido, odore di aglio, si può percepire nell’aria dopo un fulmine
- 37. Un solo atomo di Cloro può decomporre migliaia di molecole di ozono; ugualmente può accadere per
- 39. reagenti tempo prodotti V1=V2
- 40. REAZIONI IRREVERSIBILI REAZIONI REVERSIBILI Velocità reazione diretta v1 = k1 [A]a[B]b Velocità reazione inversa v2 =
- 41. Un sistema si dice in equilibrio chimico quando Le velocità della reazione diretta e inversa sono
- 42. A+B ↔ C+D V1= k1[A][B] se V1=V2 , k1 [A][B]=k2 [C][D] ; V2=k2[C][D] Questa legge è
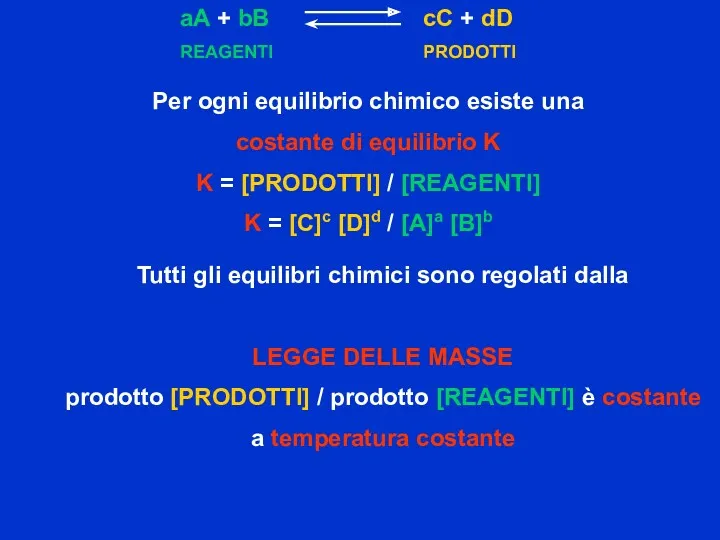
- 43. Per ogni equilibrio chimico esiste una costante di equilibrio K K = [PRODOTTI] / [REAGENTI] K
- 44. K > 1: numeratore > denominatore, la formazione dei PRODOTTI è favorita K REAGENTI è favorita
- 45. Per tutti gli equilibri chimici è valido il PRINCIPIO DI LE CHATELIER (1888) In un sistema
- 46. Consideriamo il sistema all’equilibrio
- 47. A + B C + D + temperatura REAGENTI PRODOTTI K = [C] [D] / [A]
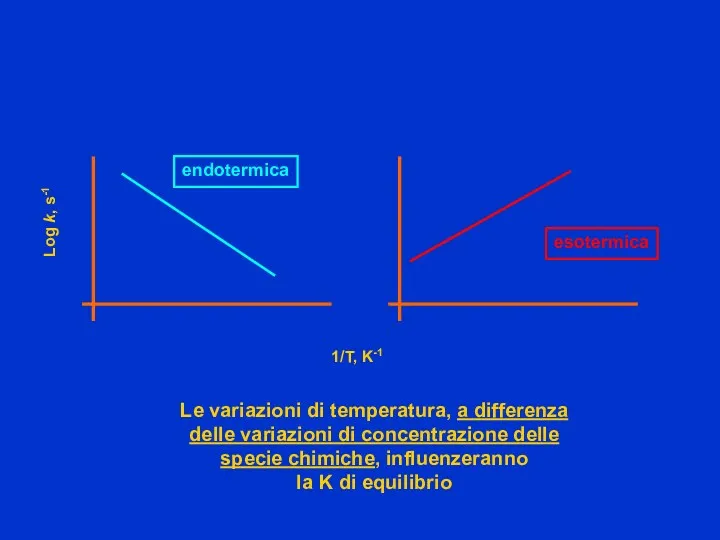
- 49. 1/T, K-1 Log k, s-1 endotermica Le variazioni di temperatura, a differenza delle variazioni di concentrazione
- 50. Le “cose importanti” da portarsi a casa All’equilibrio la velocità della reazione diretta ed inversa si
- 51. Aspetti quantitativi Se le quantità presenti all’equilibrio sono: sostituendo nella espressione della K questi valori E’
- 52. Da queste premesse segue che, noti i valori della K e delle concentrazioni iniziali, si possono
- 53. Il valore di x ricavato dalle eq. precedenti deve essere sostituito nella eq. della Keq per
- 54. La costante di equilibrio di A+B↔C+D è uguale a 0.5. Calcolare la quantità di ogni sostanza
- 55. Verifica Si sostituiscono i valori ottenuti per verificare che la K calcolata sia uguale a quella
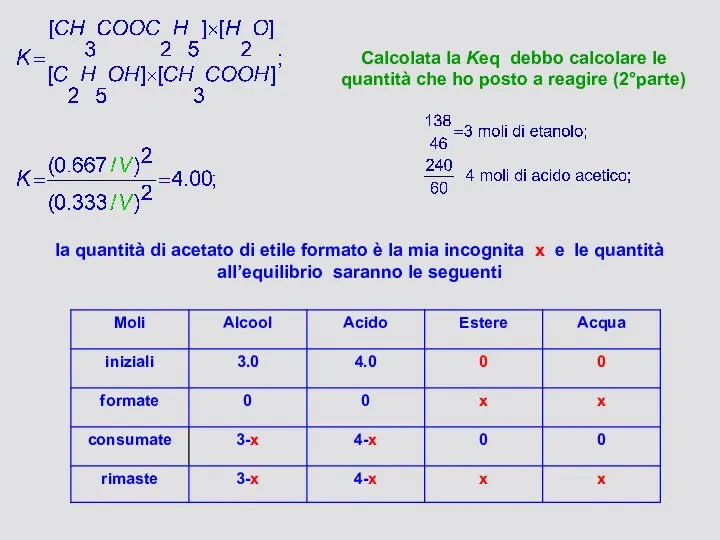
- 56. Esempio In un recipiente si mescolano 1 mole di acido acetico (MW=60) ed 1 di alcool
- 57. Calcolata la Keq debbo calcolare le quantità che ho posto a reagire (2°parte) la quantità di
- 58. Trasferisco i dati nella eqn della K di equilibrio
- 60. Скачать презентацию

![V= k[O2]x[NO]2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/609016/slide-6.jpg)

![Ordine di reazione conc tempo prodotti reagenti V= k[reagenti] 0;](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/609016/slide-11.jpg)





















![A+B ↔ C+D V1= k1[A][B] se V1=V2 , k1 [A][B]=k2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/609016/slide-41.jpg)













 Влияние спирта на здоровье человека
Влияние спирта на здоровье человека Алифатические углеводороды. Строение, физические свойства
Алифатические углеводороды. Строение, физические свойства Альдегиды и кетоны
Альдегиды и кетоны Дисахариды и полисахариды
Дисахариды и полисахариды Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии
Бытовые химические товары. Особенности упаковки, маркировки товаров бытовой химии Introduction in bioorganic chemistry. Isomerism and structure of organic compounds
Introduction in bioorganic chemistry. Isomerism and structure of organic compounds ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Природні ароматичні сполуки
Природні ароматичні сполуки Электронные конфигурации атомов
Электронные конфигурации атомов Метод окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования Вещества. Чистые вещества. Смеси
Вещества. Чистые вещества. Смеси Вода – основа жизни на Земле
Вода – основа жизни на Земле Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Количество вещества. Молярная масса. Молярный объем
Количество вещества. Молярная масса. Молярный объем Методы анализа. Классификация методов анализа
Методы анализа. Классификация методов анализа Реакции ионного обмена
Реакции ионного обмена Кислотно-основное титрование в неводных средах
Кислотно-основное титрование в неводных средах Коллигативные свойства растворов
Коллигативные свойства растворов Химические свойства неорганических соединений. Лабораторная работа
Химические свойства неорганических соединений. Лабораторная работа Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение
Оксиды. Классификация, номенклатура, свойства оксидов, получение, применение Кінетика хімічних реакцій і хімічна рівновага
Кінетика хімічних реакцій і хімічна рівновага Общие методические приемы в оценке качества лекарственных форм
Общие методические приемы в оценке качества лекарственных форм Классификация химических реакций
Классификация химических реакций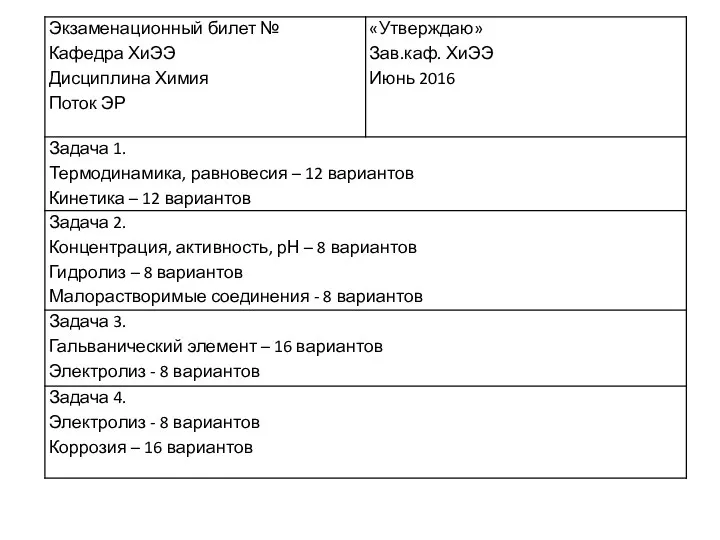 Химическая термодинамика. Задачи
Химическая термодинамика. Задачи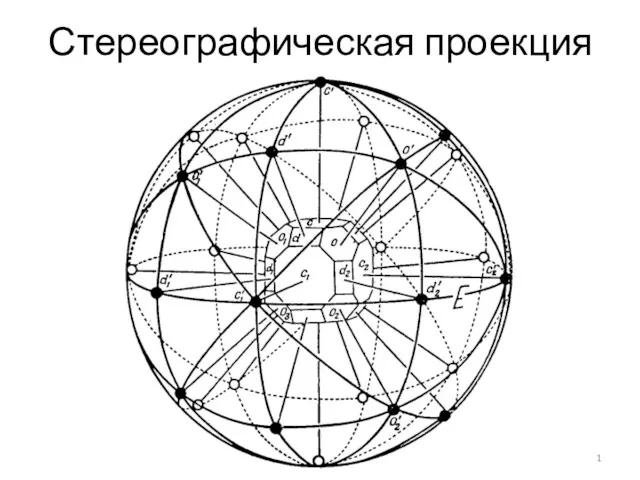 Стереографическая проекция. Ориентация кристаллов высшей категории
Стереографическая проекция. Ориентация кристаллов высшей категории Алкадиены (диены, диеновые углеводороды)
Алкадиены (диены, диеновые углеводороды) Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження
Токсичні характеристики найбільш розповсюджених небезпечних хімічних речовин і симптоми ураження