ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации презентация
Содержание
- 2. Цели и задачи Актуальность изучения золей в настоящее время заключается в том, что они применяются в
- 3. Получение золя гидроксида железа(III) 150 мл дистиллированной воды 5 мл концентрированного раствора FeCl3 (получен путем растворения
- 4. Получение золей гексацианоферрата(II) железа(III), гексацианоферрата(III) калия-железа(II) и диоксида марганца Образование конуса Тиндаля в поверхностном слое золя
- 5. Коагуляция золя гидроксида железа(III) Раствор электролита – 0,05н К2SO4 BaCl2 0,5н раствор KCl 0,5н раствор При
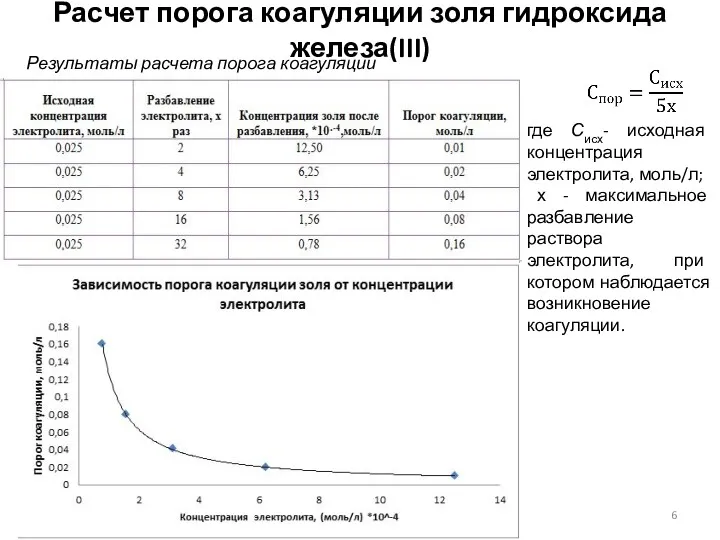
- 6. Расчет порога коагуляции золя гидроксида железа(III) где Сисх- исходная концентрация электролита, моль/л; х - максимальное разбавление
- 7. Коагуляция золя Fe4[Fe(CN)6] Система золь-электролит Результат расчета порога коагуляции золя Fe4[Fe(CN)6]3 Использован раствор электролита 1М KCl
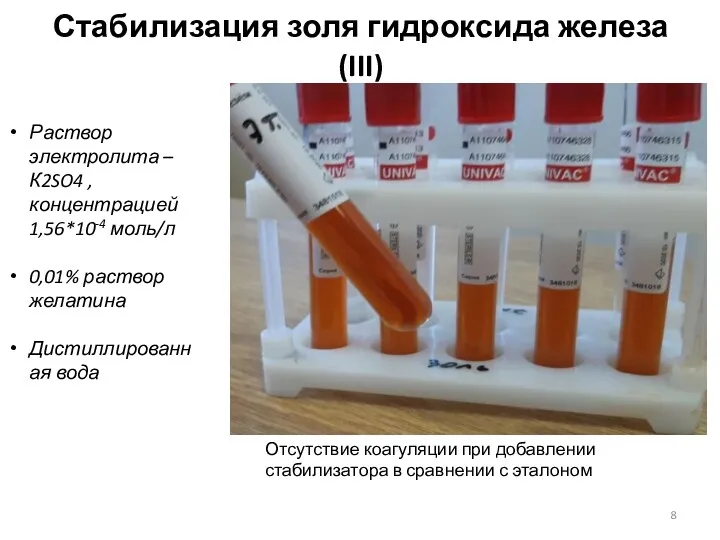
- 8. Стабилизация золя гидроксида железа(III) Отсутствие коагуляции при добавлении стабилизатора в сравнении с эталоном Раствор электролита –К2SO4
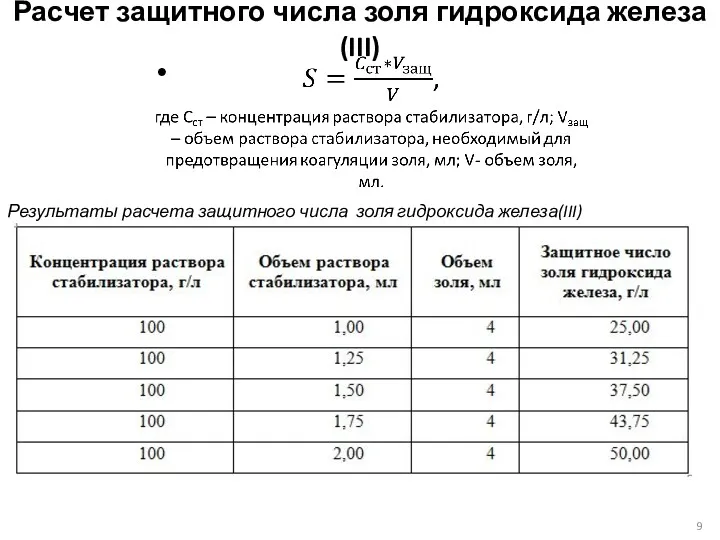
- 9. Расчет защитного числа золя гидроксида железа(III) Результаты расчета защитного числа золя гидроксида железа(III)
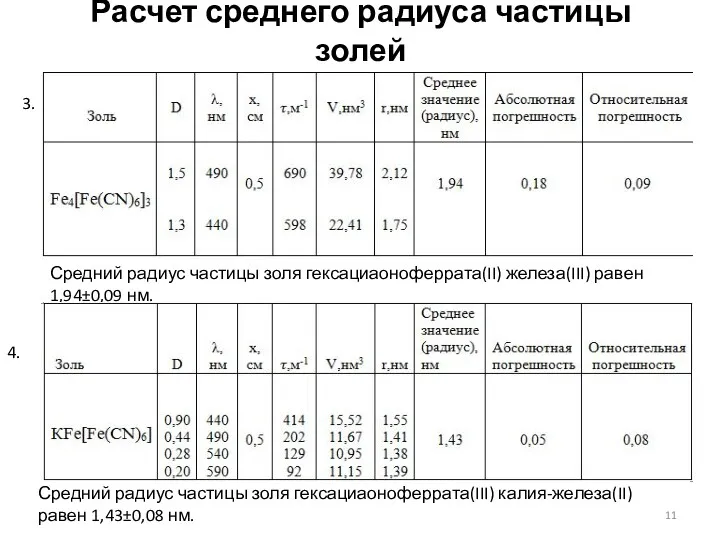
- 10. Расчет среднего радиуса частицы золей Изучение оптической плотности золей проводилось на фотоэлектрическом колориметре КФК-2-УХЛ4.2 Средний радиус
- 11. Расчет среднего радиуса частицы золей Средний радиус частицы золя гексациаоноферрата(II) железа(III) равен 1,94±0,09 нм. Средний радиус
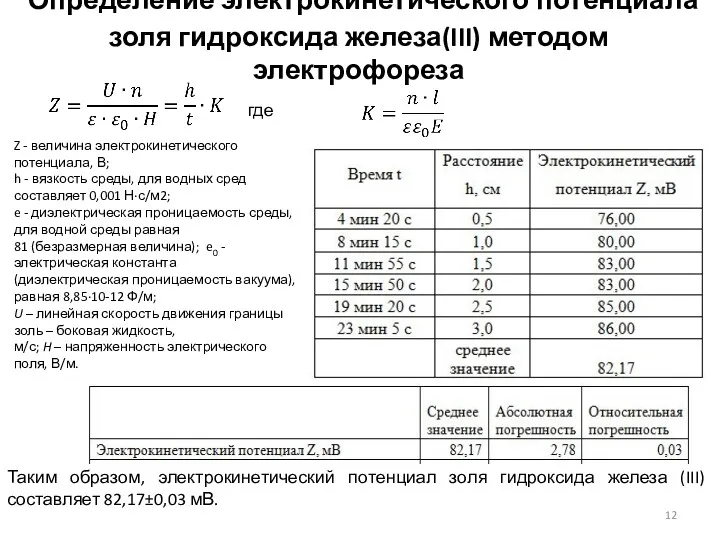
- 12. Определение электрокинетического потенциала золя гидроксида железа(III) методом электрофореза где Z - величина электрокинетического потенциала, В; h
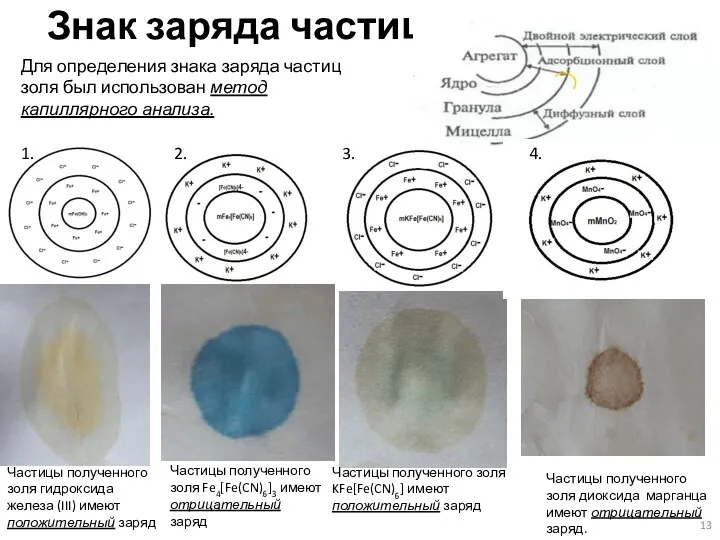
- 13. Знак заряда частиц Для определения знака заряда частиц золя был использован метод капиллярного анализа. Частицы полученного
- 14. Заключение В рамках выполнения выпускной квалификационной работы были изучены труды отечественных и зарубежных ученых, на основе
- 16. Скачать презентацию




![Коагуляция золя Fe4[Fe(CN)6] Система золь-электролит Результат расчета порога коагуляции золя](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/240549/slide-6.jpg)


 Процессы проявления и фиксирования
Процессы проявления и фиксирования Периодическая система химических элементов. Периоды
Периодическая система химических элементов. Периоды Непредельные углеводороды: общая характеристика
Непредельные углеводороды: общая характеристика Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу
Көмірсутектерді пиролиздеу арқылы қарапайым олефиндерді алу Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Растворимость веществ в воде. Растворы. 8 класс
Растворимость веществ в воде. Растворы. 8 класс Валентность химических элементов
Валентность химических элементов Химическое равновесие. Принцип Ле Шателье
Химическое равновесие. Принцип Ле Шателье Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Атомы, молекулы и ионы
Атомы, молекулы и ионы Химия нефти и газа
Химия нефти и газа Кислород
Кислород Відкриття та походження хімічних елементів
Відкриття та походження хімічних елементів Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер
Кондуктометрия. Кондуктометрия әдісі. Электрохимиялық әдістер Поліметилметакрилат
Поліметилметакрилат Скорость химических реакций. Факторы, влияющие на скорость химической реакции
Скорость химических реакций. Факторы, влияющие на скорость химической реакции Хімія у побуті
Хімія у побуті Алкадиены
Алкадиены Коррозия металлов и способы защиты от неё
Коррозия металлов и способы защиты от неё Алкадиены
Алкадиены Закон сохранения массы веществ
Закон сохранения массы веществ Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Методы количественного определения. Химические методы анализа
Методы количественного определения. Химические методы анализа Техники ювелирного дела. Введение в предмет. Общие сведения
Техники ювелирного дела. Введение в предмет. Общие сведения Vitaminele
Vitaminele Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Химический состав клетки. Неорганические вещества клетки. Урок 1
Химический состав клетки. Неорганические вещества клетки. Урок 1