Содержание
- 2. История открытия. Азот (англ. Nitrogen, франц. Azote, нем. Stickstoff) был открыт почти одновременно несколькими исследователями. Кавендиш
- 3. Строение азота Символ: N Строение атома и молекулы азота: Элемент II периода группы VA. Заряд ядра
- 4. Физические свойства азота. При обычных условиях газ, без цвета, запаха, вкуса. Плотность по воздуху: Dвоздух(N2) =
- 5. Химические свойства азота. Очень инертен. Вступает в химические реакции в жестких условиях. 1) При обычных условиях
- 6. Получение и использование азота. Способ получения элементного азота зависит от требуемой его чистоты. В промышленности: сжижение
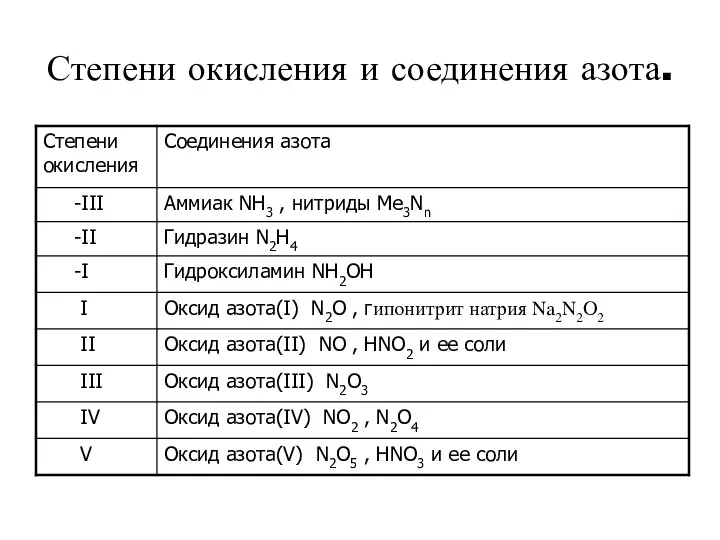
- 7. Степени окисления и соединения азота.
- 8. Оксиды азота. Оксид азота(V) N2O5 – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида
- 9. Оксиды азота. Оксид азота(IV) (Бурый газ) Ядовитый газ красно-коричневого цвета с резким запахом. Получается: 1) в
- 10. Оксиды азота. Получение концентрированной азотной кислоты: 4NO2 + 2H2O + O2 = 4HNO3 Димеризуется: 2NO2 N2O4
- 11. Оксиды азота. Оксид азота(III) Ангидрид азотистой кислоты: N2O3 + H2O = 2HNO2 Чистый N2O3 может быть
- 12. Азотная кислота. Получение: 4NH3 + 5O2 = 4NO + 6H2O (катализатор Pt) 2NO + O2 =
- 13. Азотная кислота. Реагирует с Me: Если кислота концентрированная: С малоактивными металлами: Cu + 4HNO3(K) = Cu(NO3)2
- 14. Азотная кислота. Если кислота разбавленная: С малоактивными металлами: 3Cu + 8HNO3(р) = 3Cu(NO3)2 + 4H2O +
- 15. Оксиды азота. Оксид азота(II) Бесцветный газ, плохо растворяется в воде, немного тяжелее воздуха. Получение: 1) в
- 16. Азотная кислота. Азотная кислота пассивирует с Fe, Al, Cr, Co. Золото и платина не реагируют с
- 17. Оксиды азота. В соединения с кислородом азот проявляет все свои положительные степени: N2O, NO, N2O3, NO2
- 18. Нахождение в природе. В природе существуют два стабильных изотопа азота: с массовым числом 14 (99,635%) и
- 20. Скачать презентацию
















 Альдегиды и кетоны. Лекция 10
Альдегиды и кетоны. Лекция 10 Выращивание кристаллов медного купороса в домашних условиях
Выращивание кристаллов медного купороса в домашних условиях Химические свойства алканов
Химические свойства алканов Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Электронное строение атома
Электронное строение атома Белки. Строение
Белки. Строение Минеральные вяжущие вещества, материалы и изделия на их основе
Минеральные вяжущие вещества, материалы и изделия на их основе химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя
химиияяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяяя Индикаторы кислотно-основного титрования
Индикаторы кислотно-основного титрования Катионы І - ІІІ аналитических групп
Катионы І - ІІІ аналитических групп Резина и её свойства . Полимеры и их использование
Резина и её свойства . Полимеры и их использование Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Минералы и горные породы
Минералы и горные породы Общая характеристика неметаллов
Общая характеристика неметаллов Методика обучения и воспитания на уроках химии
Методика обучения и воспитания на уроках химии Многоатомные и одноатомные спирты
Многоатомные и одноатомные спирты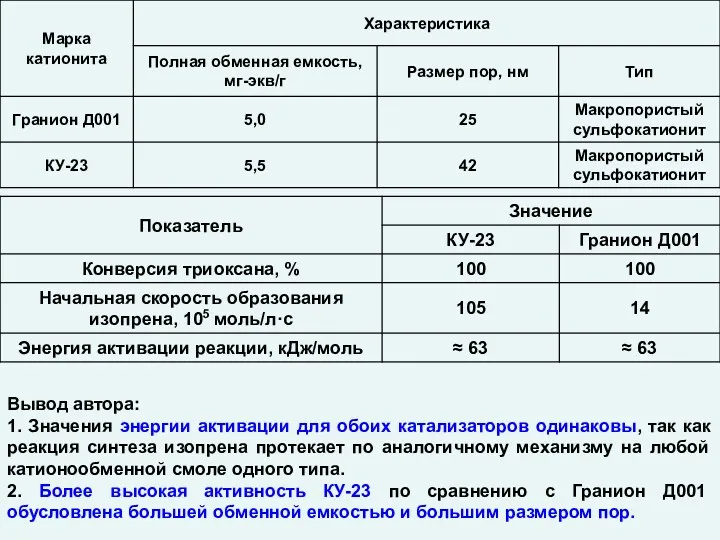 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Коррозия металлов. Способы защиты металлов от коррозии
Коррозия металлов. Способы защиты металлов от коррозии Основы термодинамики
Основы термодинамики Химическая связь. 8 класс
Химическая связь. 8 класс Электронный помощник по химии (8 класс)
Электронный помощник по химии (8 класс) Важнейшие классы бинарных соединений – оксиды и летучие соединения
Важнейшие классы бинарных соединений – оксиды и летучие соединения Химические формулы. Относительная молекулярная масса вещества
Химические формулы. Относительная молекулярная масса вещества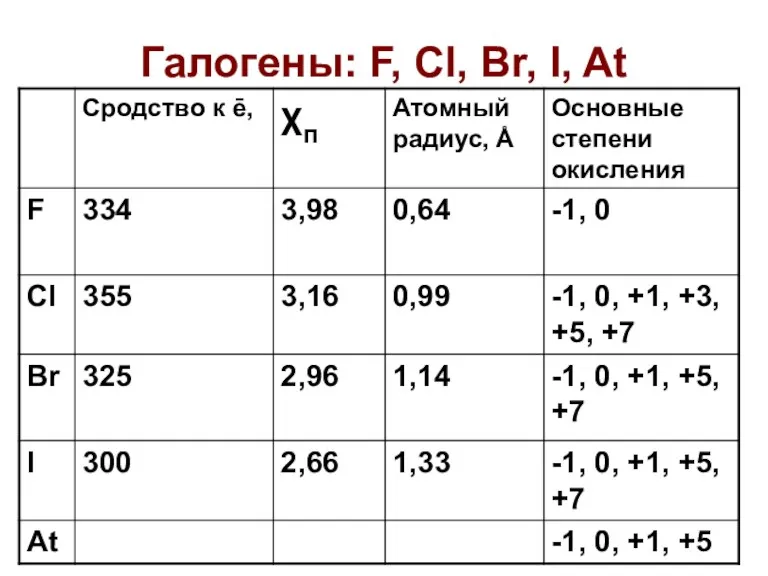 Галогены: F, Cl, Br, I, At
Галогены: F, Cl, Br, I, At Оксиды. Физические свойства
Оксиды. Физические свойства Окисно-відновні реакції у природі і промисловості
Окисно-відновні реакції у природі і промисловості Химические свойства алканов
Химические свойства алканов Гипергенез и почвообразование
Гипергенез и почвообразование