Слайд 2

Слайд 3
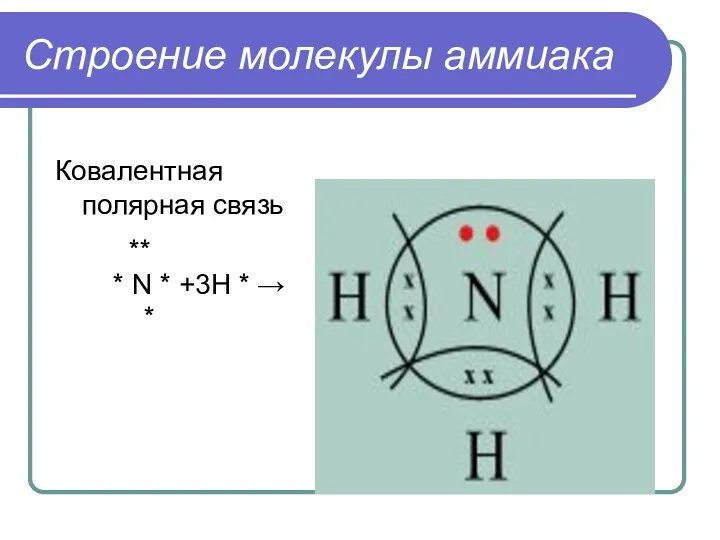
Строение молекулы аммиака
Ковалентная полярная связь
**
* N * +3H
* →
*
Слайд 4
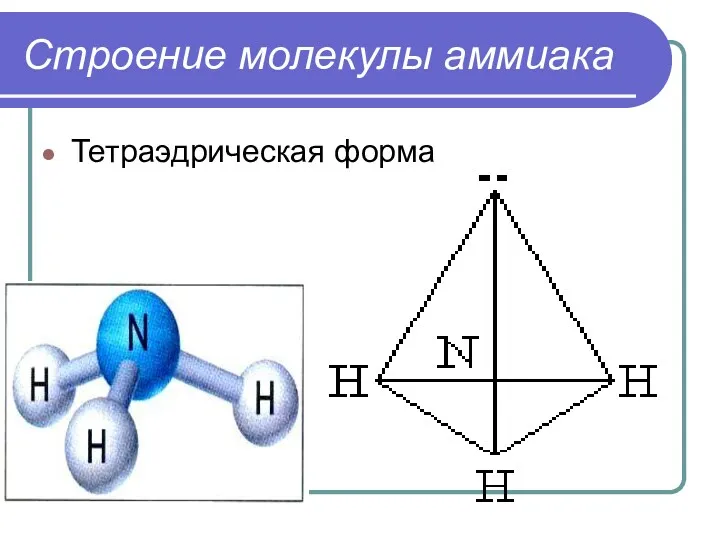
Строение молекулы аммиака
Тетраэдрическая форма
Слайд 5
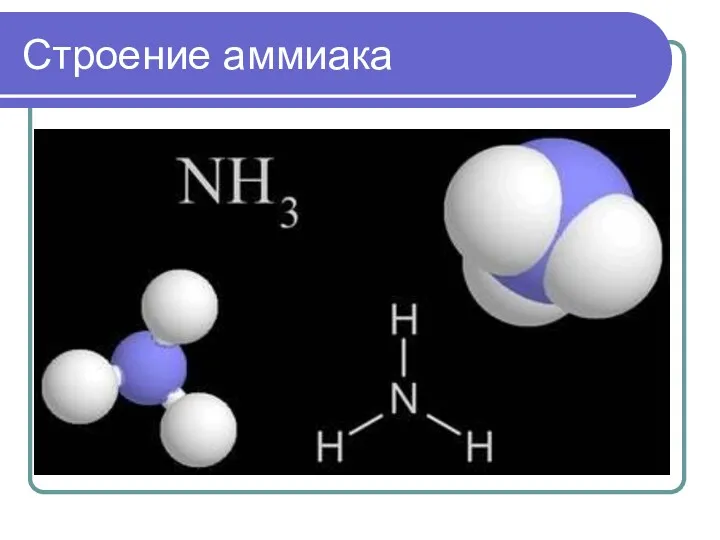
Слайд 6
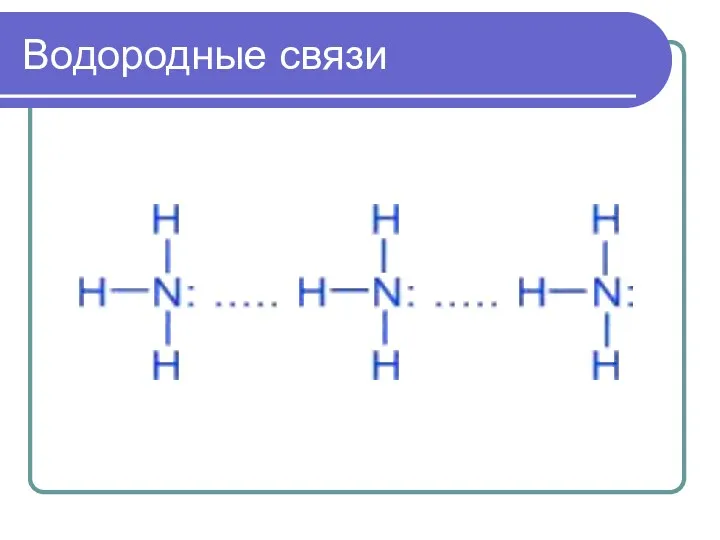
Слайд 7

Водородные связи
Химическая связь между атомом водорода и атомами очень электроотрицательных элементов
(фтора, хлора, азота ), имеющих неподеленные электронные пары другой молекулы.
Слайд 8

Физические свойства
-бесцветный газ, запах резкий, удушливый, ядовит, легче воздуха в
два раза;
t кип.= -33,40C; tпл.= -780C;
-хорошо растворим в воде: в 1л Н2O
растворяется 750л NH3 (при t=200C );
-жидкий аммиак легко сжижается .
Слайд 9

Получение
1. Промышленный способ
N2 + 3Н2 → 2NH3
(p=1000 атм; t= 5000C;
kat = Fe + алюмосиликаты; принцип циркуляции).
..\..\таблицы\аммиак. ..\..\таблицы\аммиак.docx
Слайд 10

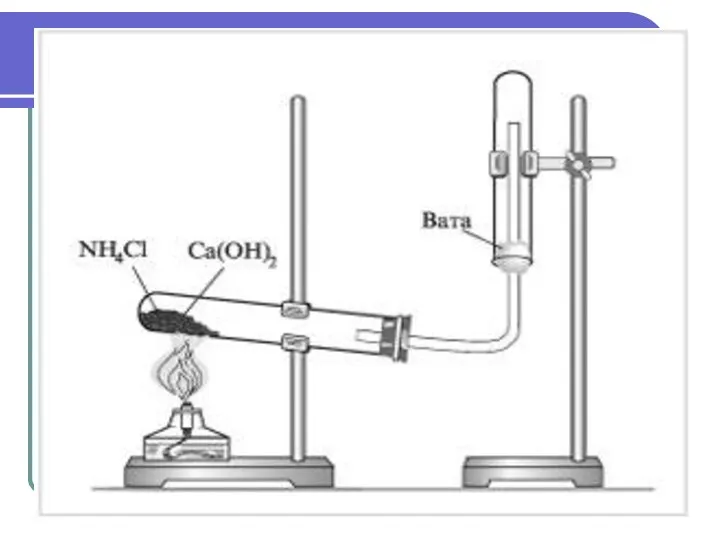
Получение
Лабораторный способ.
Нагревание солей аммония со щелочами.
2NH4Cl + Ca(OH)2→ CaCl2 +
2NH3↑+ 2Н2O
(NH4)2SO4 + 2KOH → K2SO4 + 2NH3↑+ 2Н2O
Слайд 11
Слайд 12

Слайд 13

Слайд 14

Химические свойства
1.Взаимодействие с водой
NH3 + Н2O → NH4OH
(гидроксид аммония)
NH4OH →NH4+ + OH-
(ион аммония)
Раствор аммиака в воде- аммиачная вода или нашатырный спирт, окрашивает фенолфталиин в малиновый цвет.
Слайд 15
.
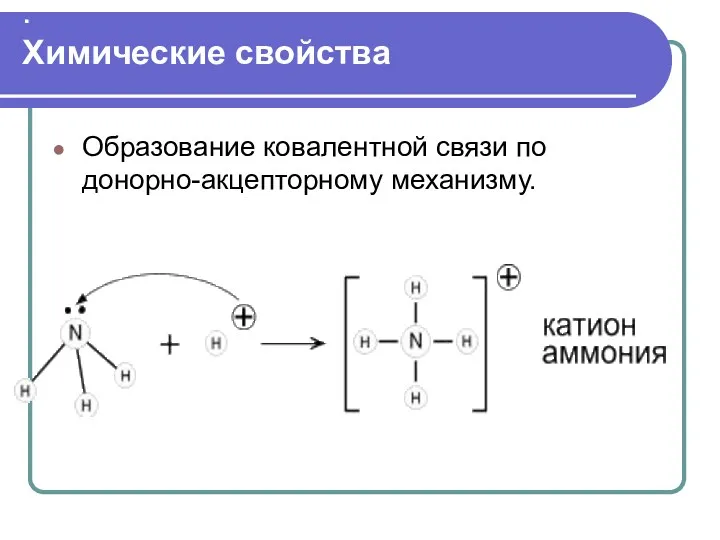
Химические свойства
Образование ковалентной связи по донорно-акцепторному механизму.
Слайд 16

Химические свойства
2. С кислотами с образованием солей аммония.
NH3 + HCl →
NH4Cl
(хлорид аммония, нашатырь)
2NH3 + H2SO4 → (NH4) 2SO4
NH3 + H2SO4 → NH4НSO4 (гидросульфат аммония)
Слайд 17
2.С кислотами с образованием солей аммония.
NH3 + H2O + CO2 →
NH4HCO3
(ГИДРОКАРБОНАТ АММОНИЯ)
2NH3 + H2O + CO2 → (NH4)2CO3
Слайд 18

Химические свойства
3.Разложение при нагревании
2NH3 → N2↑+ 3H2↑
4.Восстановление оксидов некоторых металлов
3CuO
+2NH3 → N2↑+ 3H2О+3Cu
Слайд 19

5. Горение в кислороде
a)без катализатора
4NH3 + 3O2 →2 N2 ↑+ 6H2О
Слайд 20

б)каталитическое окисление ( kat = Pt )
4NH3 + 5O2 →4 NО+
6H2О



















 Зеленая химия и проблемы устойчивого развития
Зеленая химия и проблемы устойчивого развития Аминокислоты. Пептиды. Хроматографические методы исследования
Аминокислоты. Пептиды. Хроматографические методы исследования The halogens
The halogens Материаловедение. Свойства материалов. (Тема 2)
Материаловедение. Свойства материалов. (Тема 2) Ароматичні вуглеводні (Арени). Бензен
Ароматичні вуглеводні (Арени). Бензен Крахмал. Строение вещества
Крахмал. Строение вещества Alkynes
Alkynes Химиялық реакциялардың типтері
Химиялық реакциялардың типтері Природные источники углеводородов
Природные источники углеводородов Топливо. Виды топлива
Топливо. Виды топлива p-элементы 17 группы периодической системы: галогены
p-элементы 17 группы периодической системы: галогены Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями
Кристалічна ґрадка. Встановити взаємозв’язок між будовою речовин та їх фізичними властивостями Ионные уравнения реакции
Ионные уравнения реакции Гидродинамические модели реакторов. Лекция № 2
Гидродинамические модели реакторов. Лекция № 2 Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас
Класифікація хімічних реакцій за кількістю і складом реагентів та продуктів реакції. 9 клас Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук Гидролиз. Классификация солей
Гидролиз. Классификация солей Аминокислоты. Номенклатура
Аминокислоты. Номенклатура Коррозия и методы борьбы с ней
Коррозия и методы борьбы с ней Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Механохимиялық активтеу әдісі. Реакция түрлері
Механохимиялық активтеу әдісі. Реакция түрлері Heavy metals
Heavy metals Lipid metabolism
Lipid metabolism Основные разделы химии
Основные разделы химии Кислоты
Кислоты Химический элемент. Электронное строение атома
Химический элемент. Электронное строение атома Tungsten. (Вольфрам)
Tungsten. (Вольфрам)