Содержание
- 2. План характеристики химического элемента Положение в ПСХЭ (порядковый номер, относительная атомная масса, период (какой), группа и
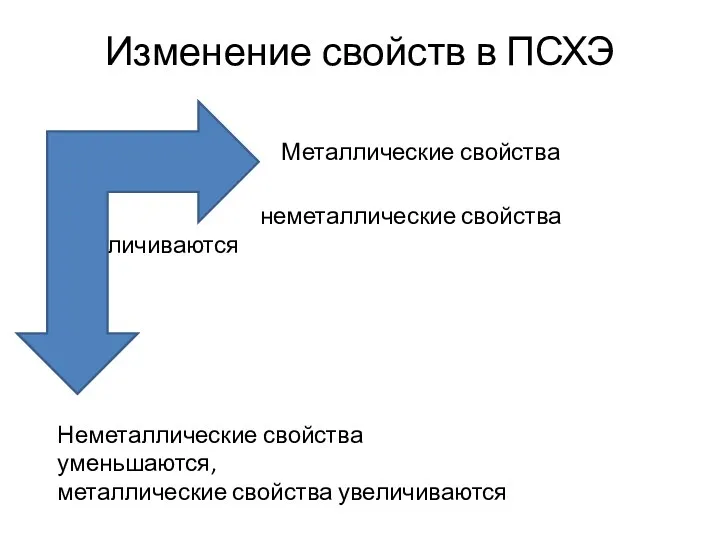
- 3. Изменение свойств в ПСХЭ Металлические свойства уменьшаются, неметаллические свойства увеличиваются Неметаллические свойства уменьшаются, металлические свойства увеличиваются
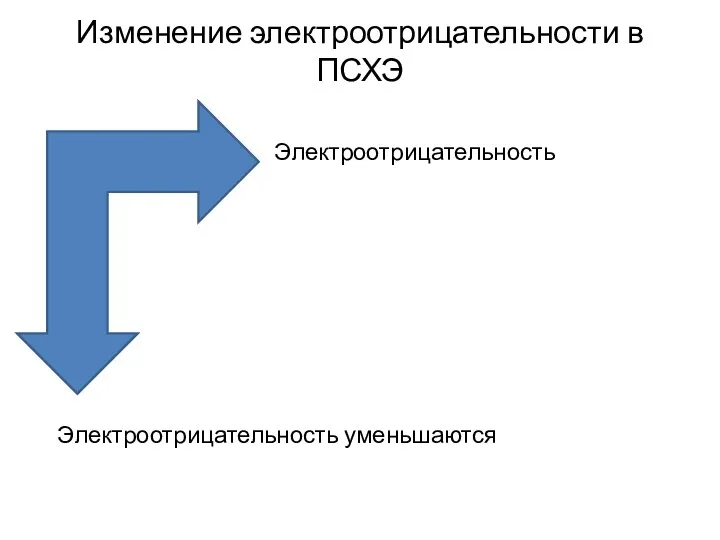
- 4. Изменение электроотрицательности в ПСХЭ Электроотрицательность увеличивается Электроотрицательность уменьшаются
- 5. Строение электронных оболочек Электроны внешнего слоя движутся попарно (спаренные электроны), или отдельно (свободные, неспаренные электроны). Количество
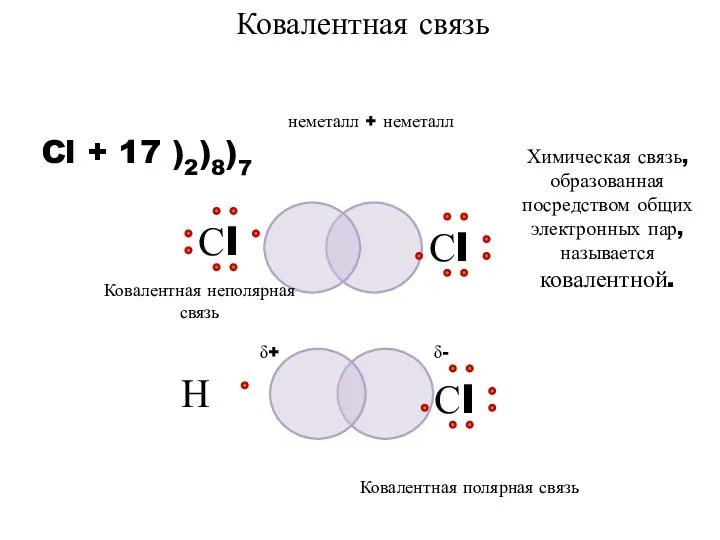
- 6. неметалл + неметалл Cl + 17 )2)8)7 Ковалентная связь Химическая связь, образованная посредством общих электронных пар,
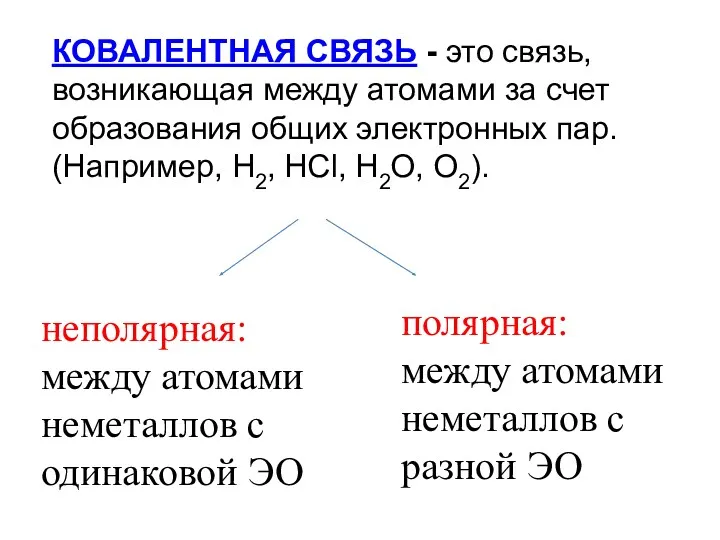
- 7. КОВАЛЕНТНАЯ СВЯЗЬ - это связь, возникающая между атомами за счет образования общих электронных пар. (Например, H2,
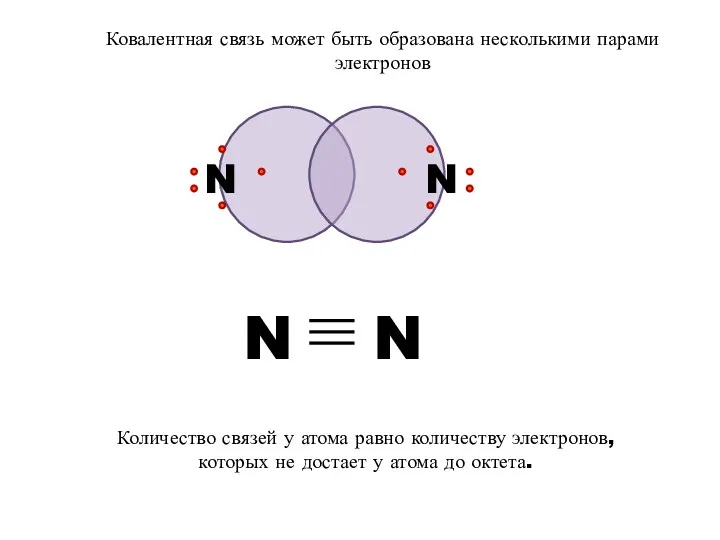
- 8. N N Ковалентная связь может быть образована несколькими парами электронов Количество связей у атома равно количеству
- 9. Ионы и ионная химическая связь.
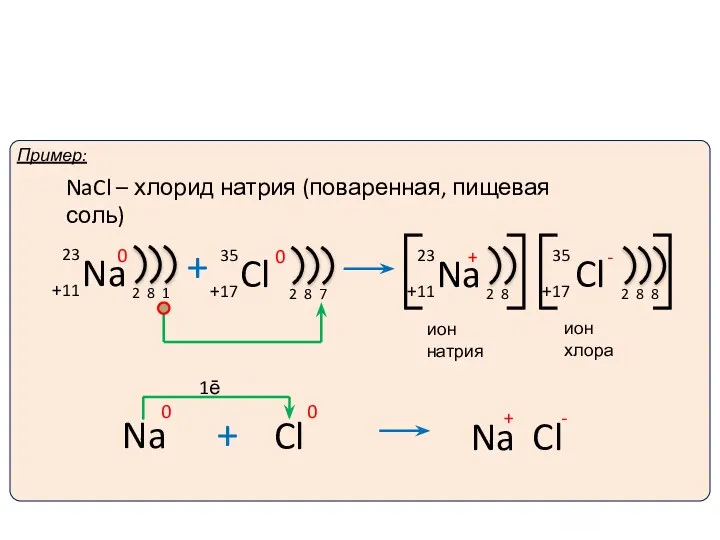
- 10. Ионы и ионная химическая связь. 1ē
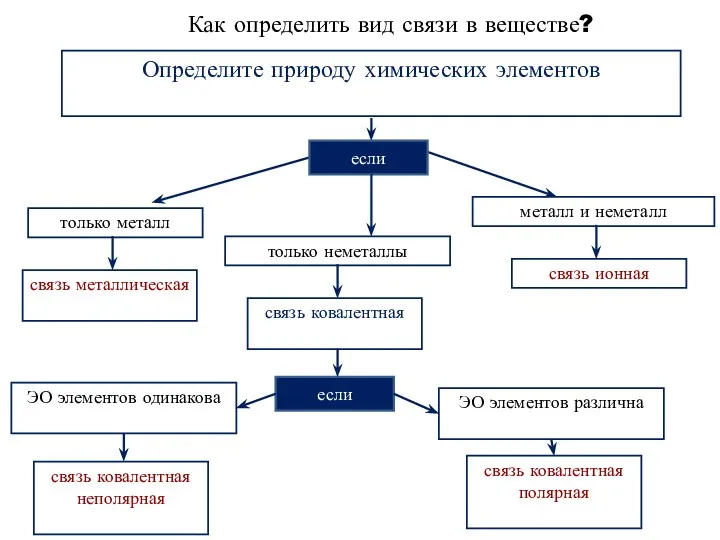
- 11. Как определить вид связи в веществе? Определите природу химических элементов если только металл только неметаллы металл
- 12. Закрепление Выпишите отдельно формулы веществ с ковалентной полярной и неполярной связями, ионной связью: H2S, KCl, O2,
- 14. Скачать презентацию




 Фенолы
Фенолы Алюминий и бор
Алюминий и бор Одноатомные спирты
Одноатомные спирты Спирты
Спирты Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Аргентум, или серебро
Аргентум, или серебро Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Каменный уголь. Фенол
Каменный уголь. Фенол Органическая химия. Олигосахариды. Полисахариды
Органическая химия. Олигосахариды. Полисахариды 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов Термодинамика химического равновесия
Термодинамика химического равновесия Зерттеу әдістері
Зерттеу әдістері Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Химические понятия
Химические понятия Спирти
Спирти Необратимые электродные процессы. Часть 2
Необратимые электродные процессы. Часть 2 Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Простые вещества - неметаллы
Простые вещества - неметаллы Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Растворы. Массовая доля растворённого вещества
Растворы. Массовая доля растворённого вещества Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Физико-химические свойства алкенов
Физико-химические свойства алкенов Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения