Содержание
- 2. Содержание Гетерогенное равновесие в насыщенном растворе малорастворимого сильного электролита. Произведение растворимости Влияние на растворимость электролита введения
- 3. Произведение растворимости Гетерогенное равновесие в насыщенном водном растворе малорастворимого сильного электролита KmAn между осадком электролита и
- 4. Значения ПР малорастворимых электролитов при 250С В насыщенном растворе сильного малорастворимого электролита произведение равновесных молярных концентраций
- 5. Расчет растворимости СаСО3 Обозначим S – растворимость карбоната кальция , моль/л – растворимость карбоната кальция ,
- 6. Соотношение растворимости и ПР Для малорастворимого электролита KmAn, растворимость которого S KmAn(к) mKn+ + nAm- Концентрации
- 7. Расчет растворимости Сa3(PO4)2 и Ag2S Растворимость Сa3(PO4)2 (m = 3, n = 2) Растворимость Ag2S (m
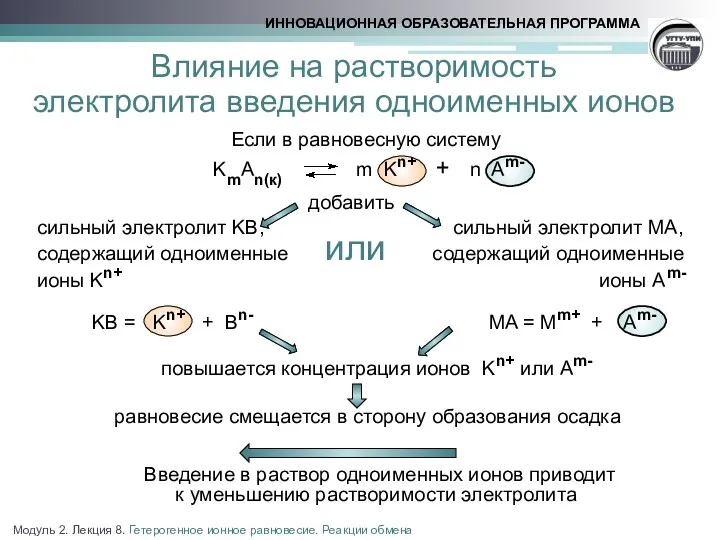
- 8. Если в равновесную систему KmAn(к) m Kn+ + n Am- добавить сильный электролит KB, сильный электролит
- 9. СdСО3(к) Сd2+ + СО32- Растворимость карбоната кадмия Расчет растворимости карбоната кадмия в 0,1М растворе Na2CO3 Концентрация
- 10. Условие выпадения и растворения осадка Используя значение ПР, можно определить возможность образования или растворения осадка в
- 11. Определение возможности образования осадка BaSO4 Определите, образуется ли осадок BaSO4 при сливании равных объемов 0,001 М
- 12. Реакции обмена в растворах электролитов Обменные реакции (реакции обмена) – реакции в растворах электролитов, в ходе
- 13. Примеры необратимых реакций обмена Образование малорастворимого вещества (осадка) Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3 Pb2+
- 14. Направление реакций обмена Реакции, в которых исходные вещества и продукты реакции содержат малорастворимые соединения, должны быть
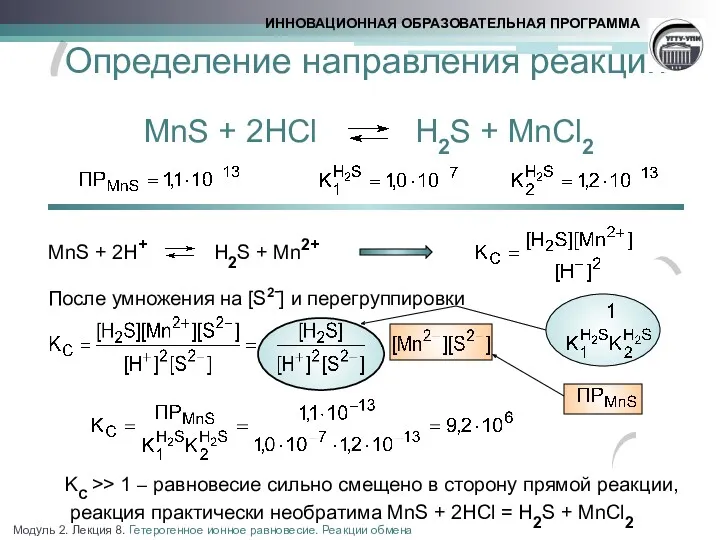
- 15. Определение направления реакции MnS + 2HCl H2S + MnCl2 MnS + 2H+ H2S + Mn2+ После
- 16. Определение направления реакции CuS + 2HCl H2S + CuCl2 CuS + 2H+ H2S + Cu2+ KC
- 17. Заключение Константу равновесия в насыщенном растворе малорастворимого сильного электролита между осадком электролита и его ионами в
- 19. Скачать презентацию














 Электролиз
Электролиз Хром. Элемент VI группы побочной подгруппы
Хром. Элемент VI группы побочной подгруппы Термодинамика химического равновесия
Термодинамика химического равновесия Координационные соединения
Координационные соединения Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Свойства природного газа
Свойства природного газа Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева
Строение атома в соответствии с положением в периодической системе химических элементов Д.И. Менделеева Физико-химические свойства жиров
Физико-химические свойства жиров Инертные газы
Инертные газы Аллотропные модификации алмаза
Аллотропные модификации алмаза Автомобильные бензины
Автомобильные бензины Особо чистые вещества. Занятие 14
Особо чистые вещества. Занятие 14 Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан
Ағзаның барлық жасушасындағы белок алмасу. Аминқышқылдарының дезаминденуі, пурин және пиримидиндердің ыдырауынан Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Оксиды неметаллов
Оксиды неметаллов Сложные эфиры. Жиры
Сложные эфиры. Жиры Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Особенности сжигания твердого, жидкого и газообразного топлива
Особенности сжигания твердого, жидкого и газообразного топлива Закон сохранения масс 8 класс
Закон сохранения масс 8 класс Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические
Физико-химические методы анализа: электрохимические, спектральные (оптические) и хроматографические Натуральные, искуственные и синтетические материалы
Натуральные, искуственные и синтетические материалы Кислоты в животном и растительном мире
Кислоты в животном и растительном мире Свободные радикалы и болезни человека
Свободные радикалы и болезни человека Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 Синтез на основі бензену
Синтез на основі бензену Шыны, әйнек
Шыны, әйнек Общая характеристика галогенов
Общая характеристика галогенов