Содержание
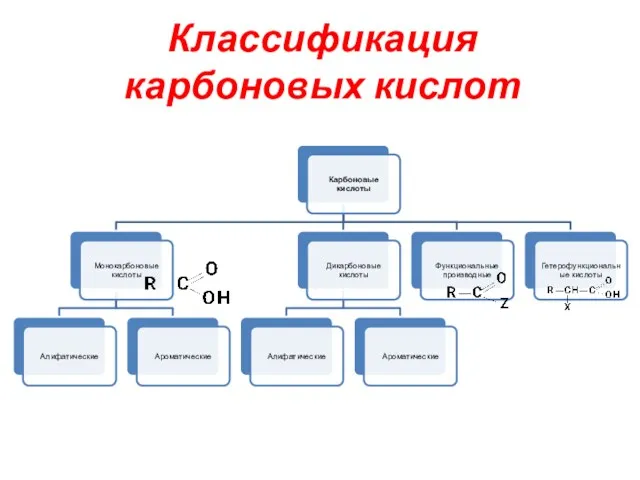
- 2. Классификация карбоновых кислот
- 3. Классификация карбоновых кислот 1. Монокарбоновые 1.1. Алифатические, насыщенные CnH2n+1 COOH метановая кислота, муравьиная кислота (формиат) этановая,
- 4. Классификация карбоновых кислот 1.2. Алифатические , ненасыщенные пропен-2-овая, акриловая кислота бутен-3-овая, винилуксусная кислота 1.3. Ароматические 1.4.
- 5. Классификация карбоновых кислот 2. Дикарбоновые 2.1. Насыщенные алифатические щавелевая(оксалат) к-та, этандиовая малоновая кислота, пропандиовая янтарная кислота,
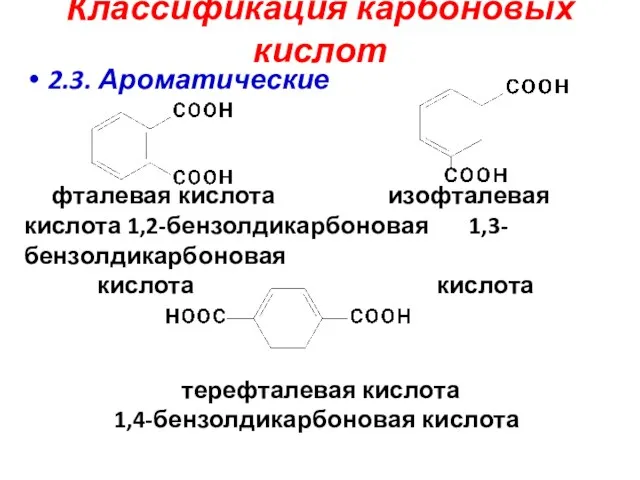
- 6. Классификация карбоновых кислот 2.3. Ароматические фталевая кислота изофталевая кислота 1,2-бензолдикарбоновая 1,3-бензолдикарбоновая кислота кислота терефталевая кислота 1,4-бензолдикарбоновая
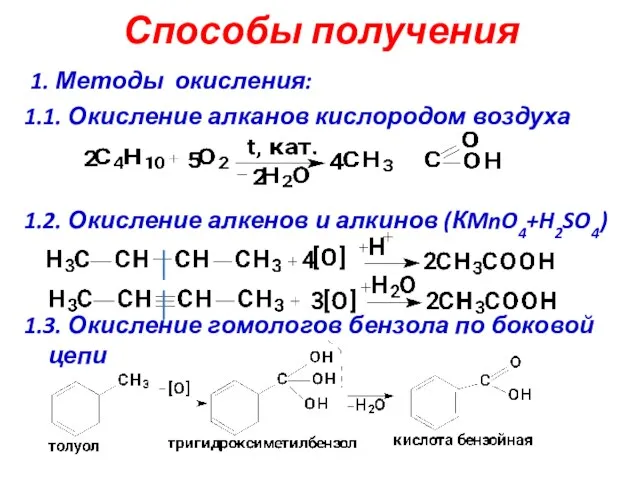
- 7. Способы получения 1. Методы окисления: 1.1. Окисление алканов кислородом воздуха 1.2. Окисление алкенов и алкинов (КMnO4+H2SO4)
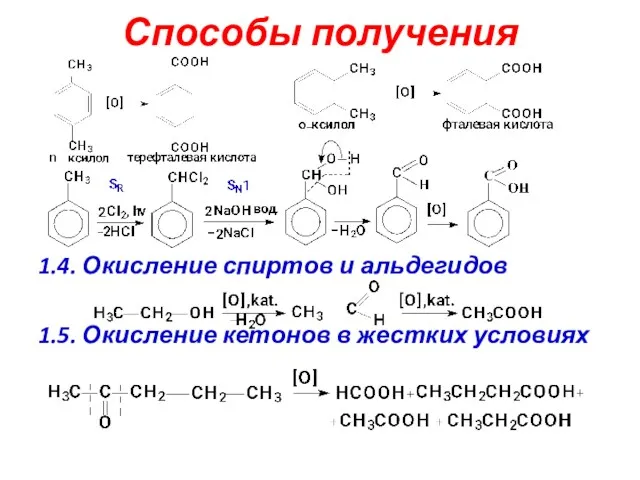
- 8. 1.4. Окисление спиртов и альдегидов 1.5. Окисление кетонов в жестких условиях Способы получения
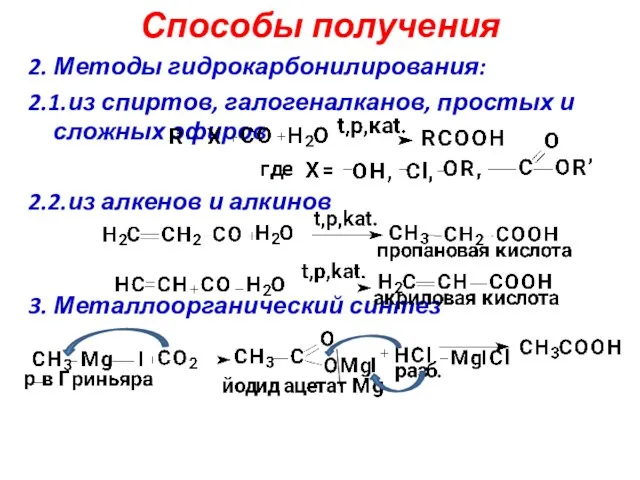
- 9. Способы получения 2. Методы гидрокарбонилирования: 2.1.из спиртов, галогеналканов, простых и сложных эфиров 2.2.из алкенов и алкинов
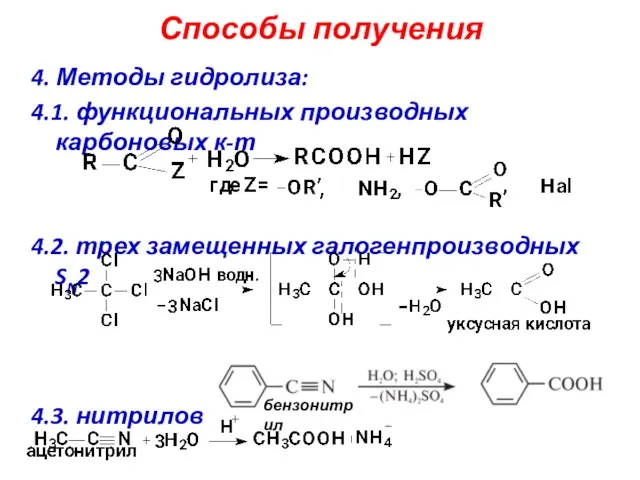
- 10. Способы получения 4. Методы гидролиза: 4.1. функциональных производных карбоновых к-т 4.2. трех замещенных галогенпроизводных SN2 4.3.
- 11. Физические свойства Начиная с муравьиной кислоты все кислоты жидкости с высокой температурой кипения. Дикарбоновые кислоты –
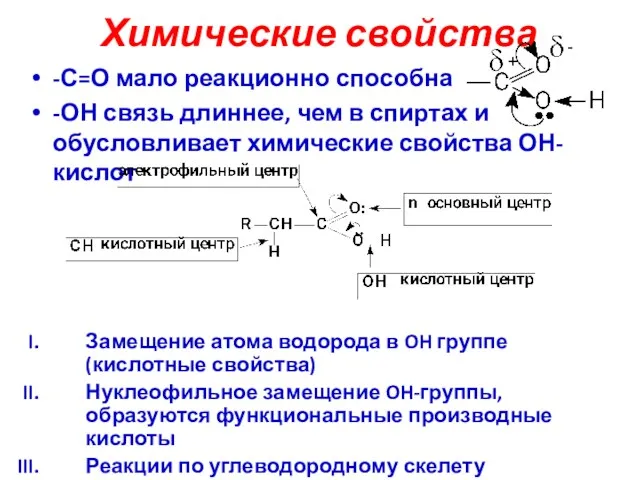
- 12. -С=О мало реакционно способна -ОН связь длиннее, чем в спиртах и обусловливает химические свойства ОН-кислот Замещение
- 13. Химические свойства Кислотные свойства: самые сильные ОН-кислоты Бренстеда Эл/дон. ↓ кислотность Эл/акц. ↑ кислотность Реакции солеобразования
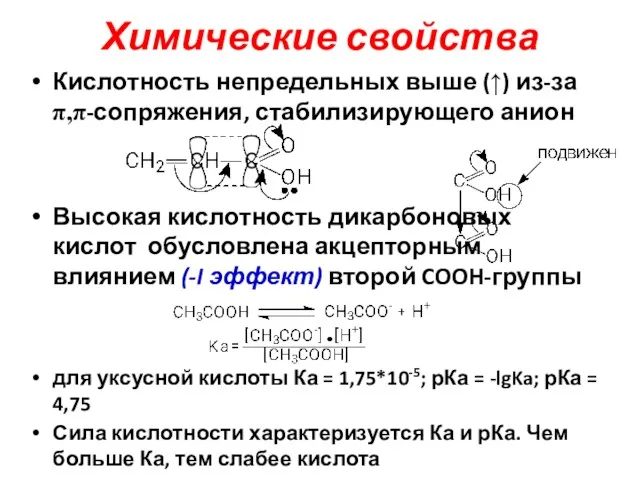
- 14. Химические свойства Кислотность непредельных выше (↑) из-за π,π-сопряжения, стабилизирующего анион Высокая кислотность дикарбоновых кислот обусловлена акцепторным
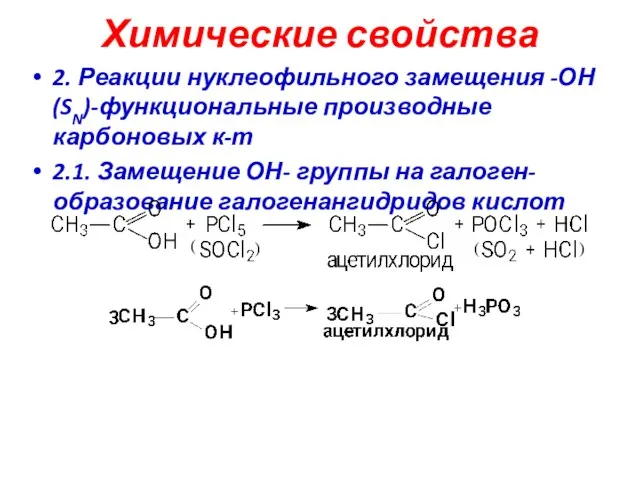
- 15. Химические свойства 2. Реакции нуклеофильного замещения -ОН (SN)-функциональные производные карбоновых к-т 2.1. Замещение ОН- группы на
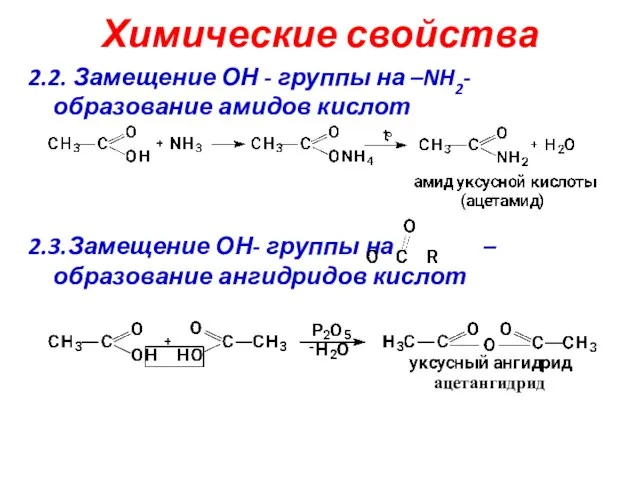
- 16. Химические свойства 2.2. Замещение ОН - группы на –NH2-образование амидов кислот 2.3.Замещение ОН- группы на –образование
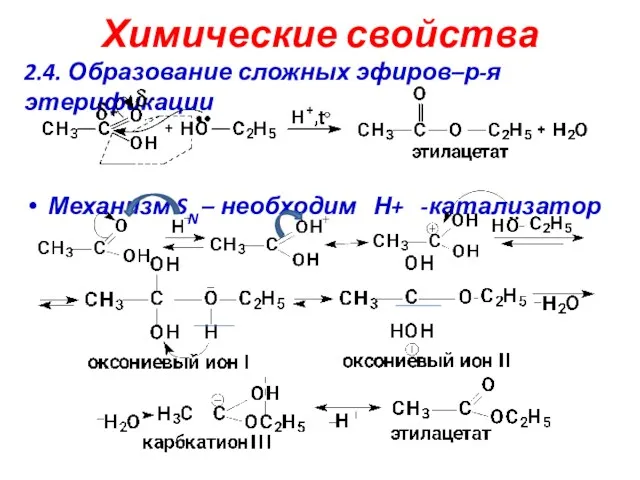
- 17. Химические свойства 2.4. Образование сложных эфиров–р-я этерификации Механизм SN – необходим Н+ -катализатор
- 18. Химические свойства 3. Реакции идущие по СН-кислотному центру 3.1. Реакция Гелля-Фольгарда-Зелинского -замещение α–Н на галогены 3.2.
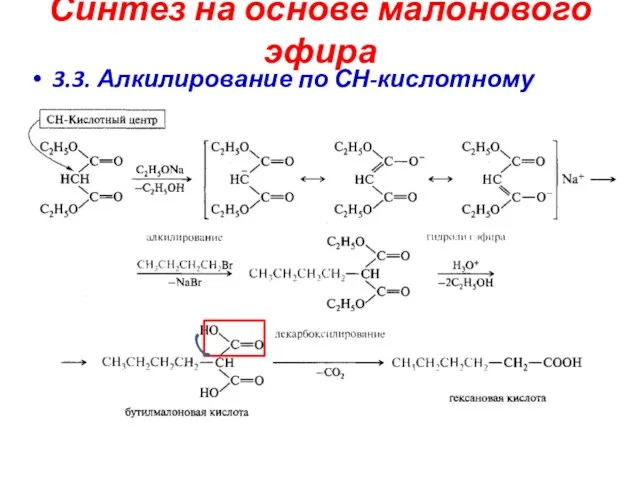
- 19. Синтез на основе малонового эфира 3.3. Алкилирование по СН-кислотному центру
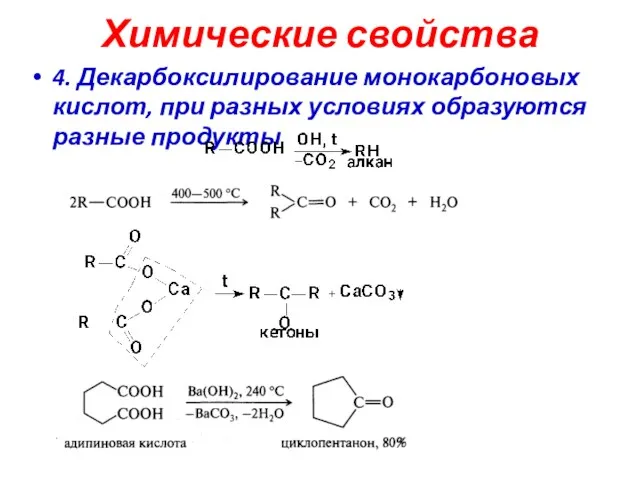
- 20. Химические свойства 4. Декарбоксилирование монокарбоновых кислот, при разных условиях образуются разные продукты
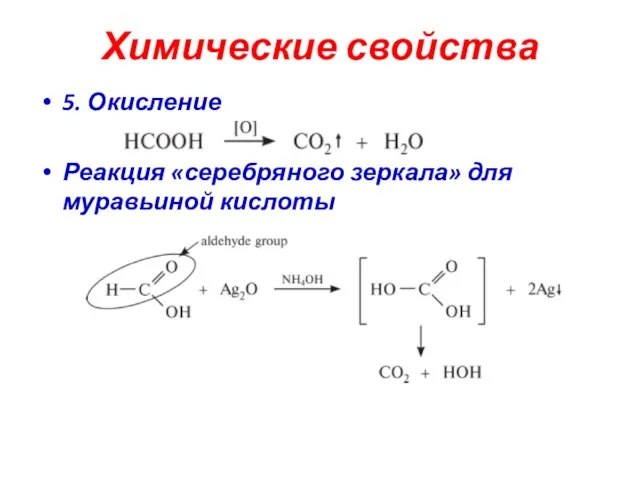
- 21. Химические свойства 5. Окисление Реакция «серебряного зеркала» для муравьиной кислоты
- 22. Получение дикарбоновых кислот 1. Окисление диолов, диальдегидов, оксикислот 2. Гидролиз динитрилов глиоксаль малоновая кислота щавелевая кислота
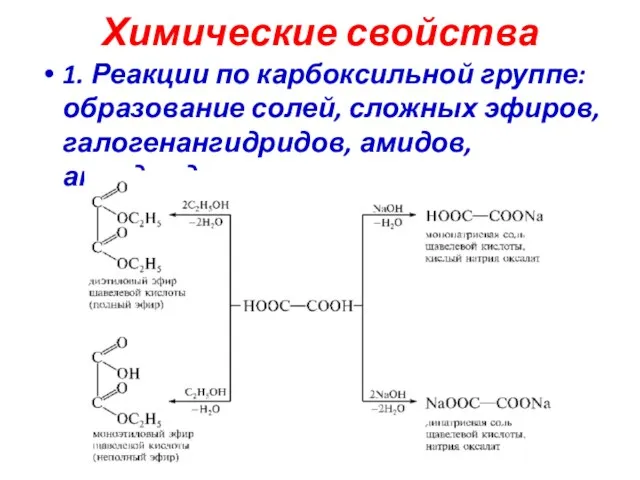
- 23. Химические свойства 1. Реакции по карбоксильной группе: образование солей, сложных эфиров, галогенангидридов, амидов, ангидридов
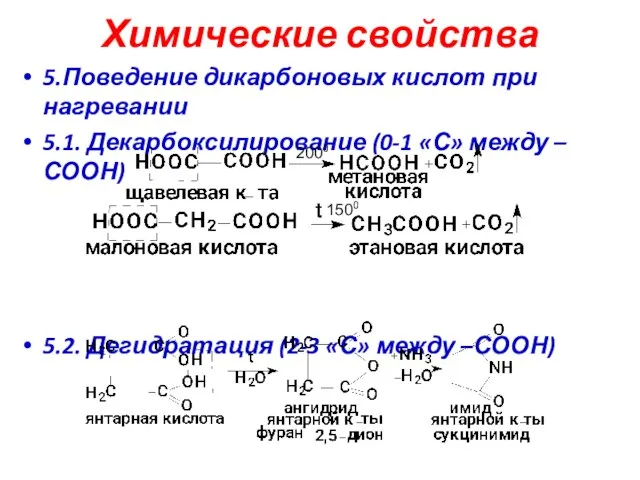
- 24. Химические свойства 5.Поведение дикарбоновых кислот при нагревании 5.1. Декарбоксилирование (0-1 «С» между –СООН) 5.2. Дегидратация (2-3
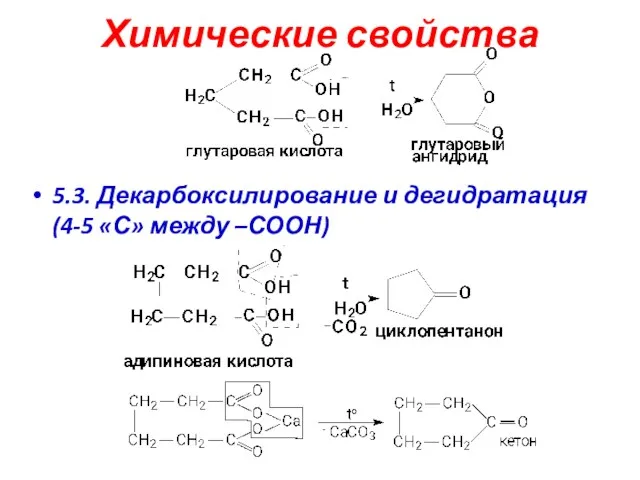
- 25. Химические свойства 5.3. Декарбоксилирование и дегидратация (4-5 «С» между –СООН)
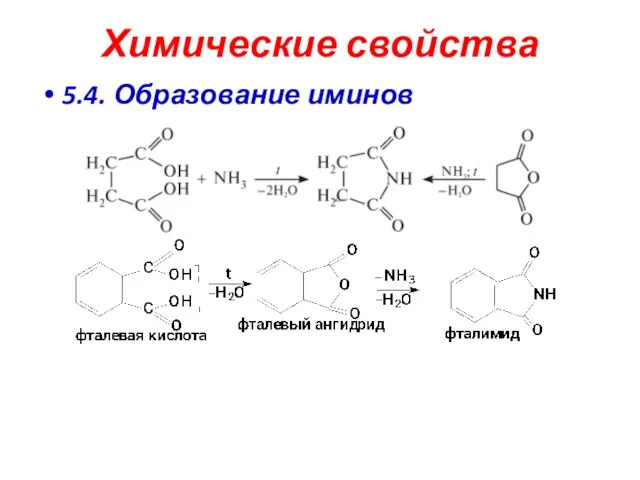
- 26. Химические свойства 5.4. Образование иминов
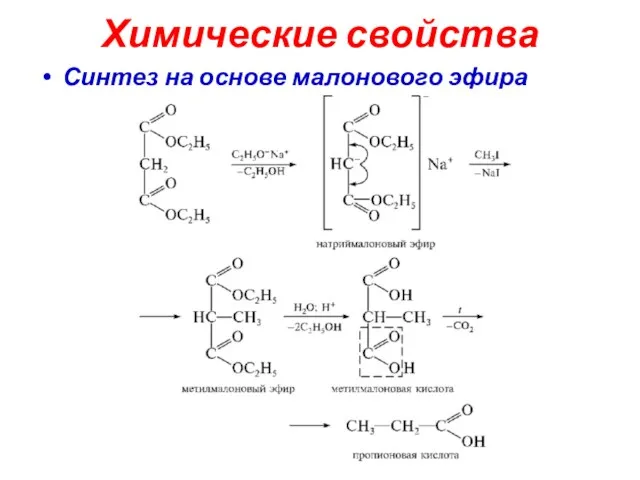
- 27. Химические свойства Синтез на основе малонового эфира
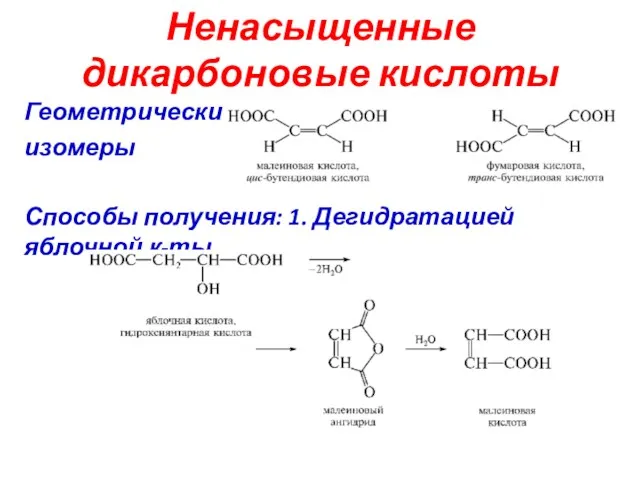
- 28. Ненасыщенные дикарбоновые кислоты Геометрические изомеры Способы получения: 1. Дегидратацией яблочной к-ты
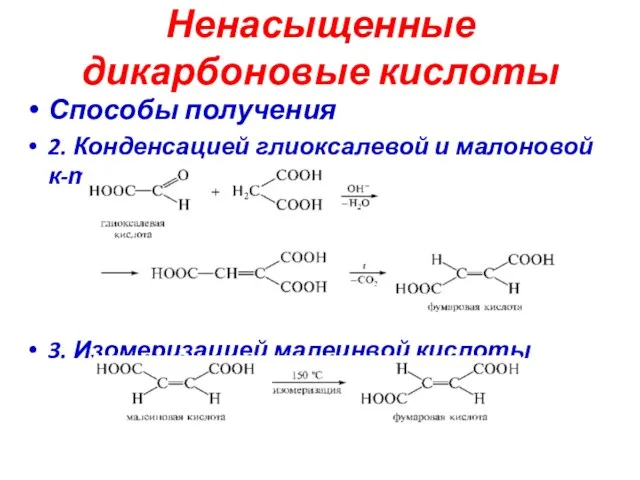
- 29. Ненасыщенные дикарбоновые кислоты Способы получения 2. Конденсацией глиоксалевой и малоновой к-т 3. Изомеризацией малеинвой кислоты
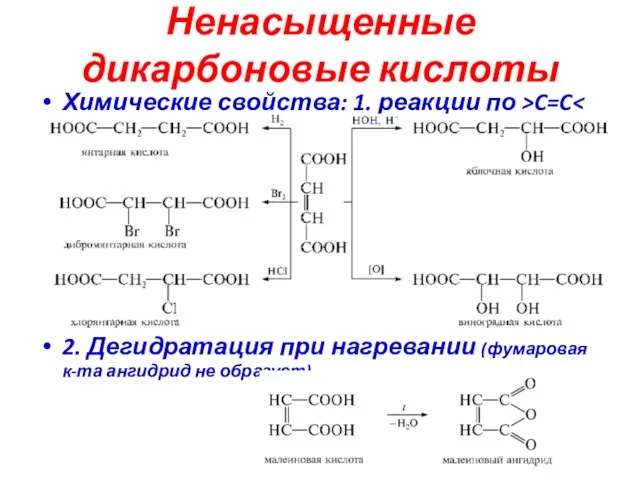
- 30. Ненасыщенные дикарбоновые кислоты Химические свойства: 1. реакции по >C=C 2. Дегидратация при нагревании (фумаровая к-та ангидрид
- 31. Гетерофункциональные карбоновые кислоты Общая формула: Галогенозамещенные кислоты Х=-Наl Гидроксикислоты, фенолокислоты Х=-ОН Оксокислоты (альдегидо- и кетокислоты) Х=-С=О
- 32. Галогенозамещенные карбоновые кислоты Благодаря -I эффекту карбоксильной группы увеличивается подвижность Hal, он легко замещается на -OH,
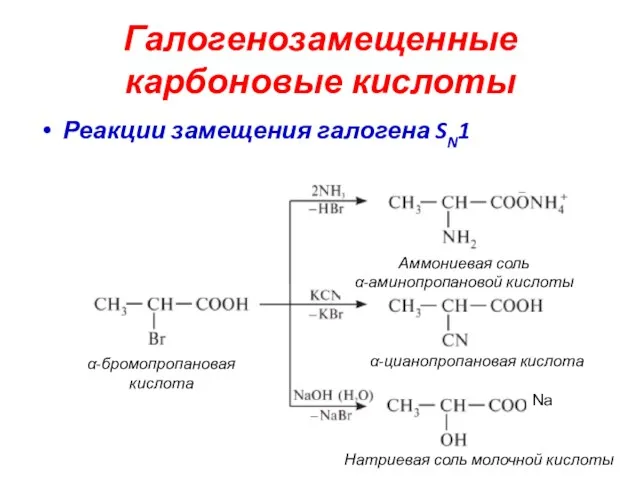
- 33. Галогенозамещенные карбоновые кислоты Реакции замещения галогена SN1 Аммониевая соль α-аминопропановой кислоты α-цианопропановая кислота Натриевая соль молочной
- 34. Гидроксикислоты молочная кислота (лактат) 2-гидроксипропановая кислота α – гидроксипропионовая кислота яблочная кислота (малат) 2-гидроксибутандиовая кислота α
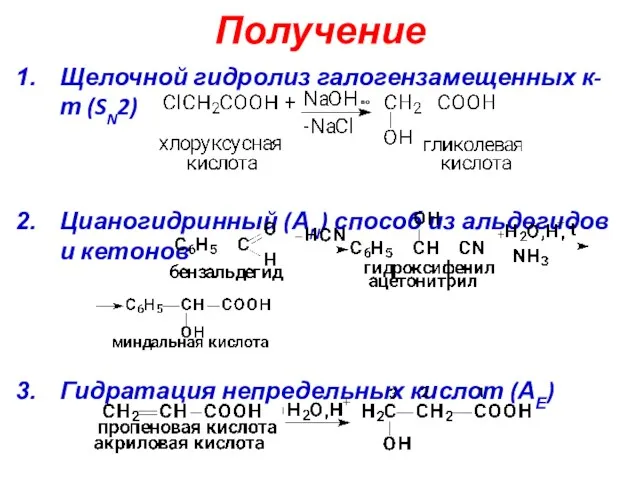
- 35. Получение Щелочной гидролиз галогензамещенных к-т (SN2) Цианогидринный (АN) способ из альдегидов и кетонов Гидратация непредельных кислот
- 36. Химические свойства гидроксикислот 1. Взаимодействие со щелочью, с натрием 2. Взаимодействие с кислотой 3.Окисление 4. Взаимодействие
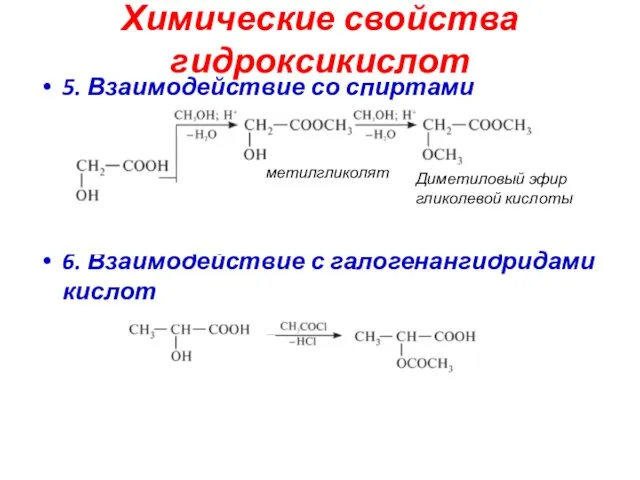
- 37. Химические свойства гидроксикислот 5. Взаимодействие со спиртами 6. Взаимодействие с галогенангидридами кислот метилгликолят Диметиловый эфир гликолевой
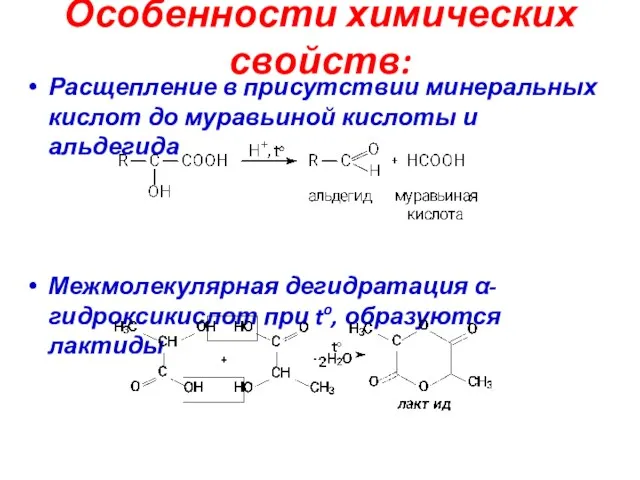
- 38. Особенности химических свойств: Расщепление в присутствии минеральных кислот до муравьиной кислоты и альдегида Межмолекулярная дегидратация α-гидроксикислот
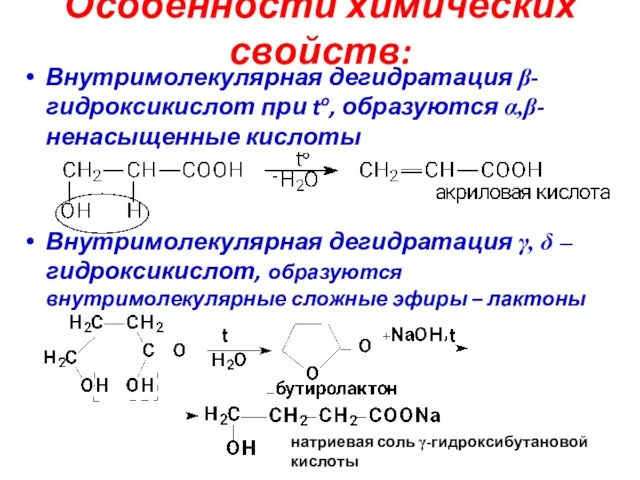
- 39. Особенности химических свойств: Внутримолекулярная дегидратация β-гидроксикислот при to, образуются α,β-ненасыщенные кислоты Внутримолекулярная дегидратация γ, δ –гидроксикислот,
- 40. Фенолокислоты Реакции с хлоридм железа Бензойная кислота Бензоат железа Салициловая кислота Салицилат железа
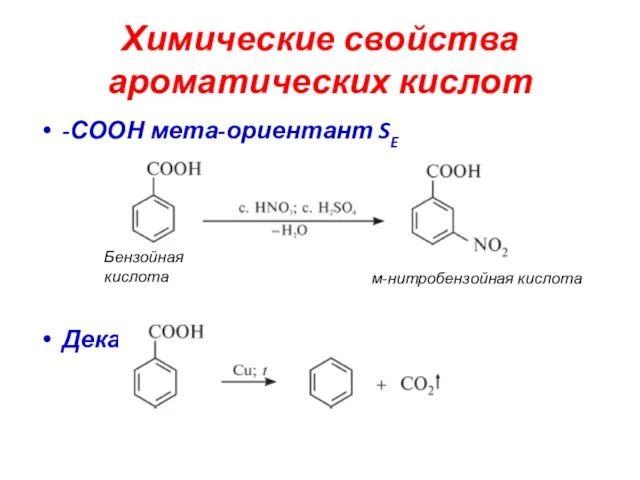
- 41. Химические свойства ароматических кислот -СООН мета-ориентант SE Декарбоксилирование Бензойная кислота м-нитробензойная кислота
- 42. Оксокислоты (альдегидо- и кето-) (пируват)
- 43. Альдегидо- и кетокислоты
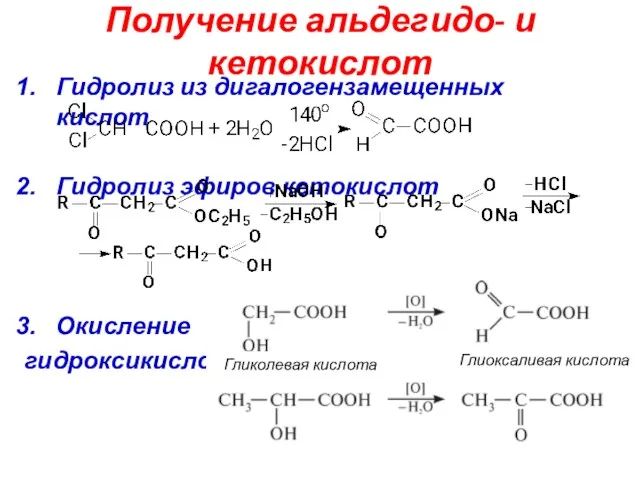
- 44. Получение альдегидо- и кетокислот Гидролиз из дигалогензамещенных кислот Гидролиз эфиров кетокислот Окисление гидроксикислот Гликолевая кислота Глиоксаливая
- 45. Химические свойства альдегидо- и кетокислот Реакции АN 1.1. Гидратация
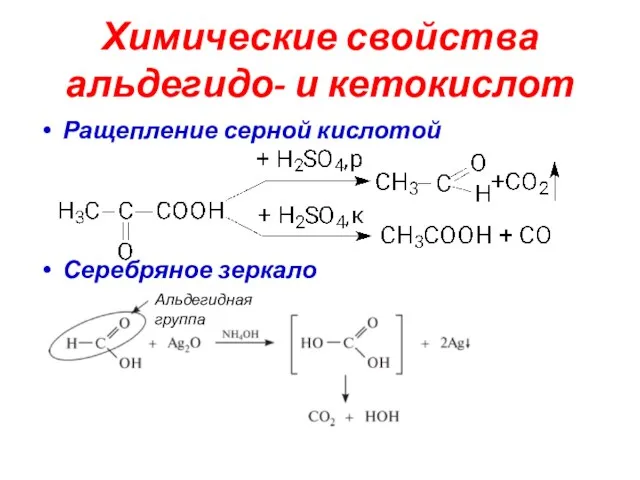
- 46. Химические свойства альдегидо- и кетокислот Ращепление серной кислотой Серебряное зеркало Альдегидная группа
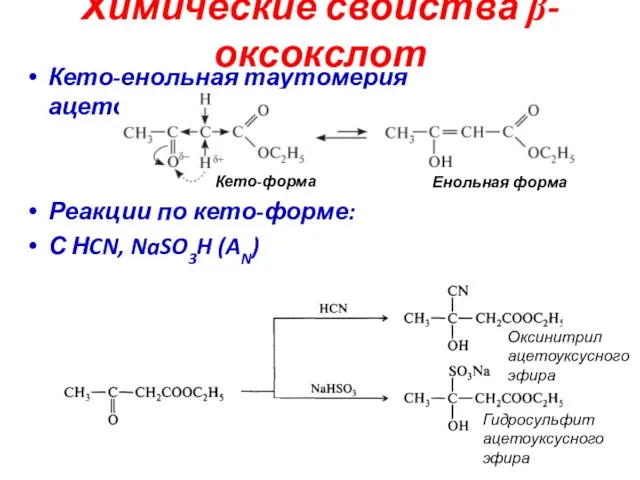
- 47. Химические свойства β-оксокслот Кето-енольная таутомерия ацетоуксусного эфира Реакции по кето-форме: С НCN, NaSO3H (AN) Кето-форма Енольная
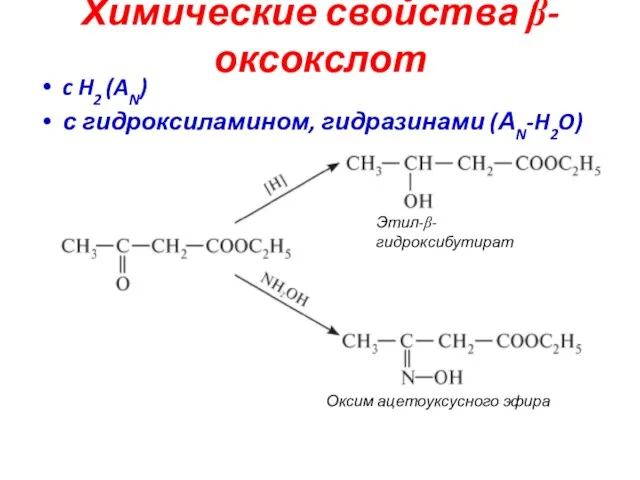
- 48. Химические свойства β-оксокслот c H2 (AN) с гидроксиламином, гидразинами (АN-H2O) Этил-β-гидроксибутират Оксим ацетоуксусного эфира
- 49. Химические свойства β-оксокслот Реакции по енольной форме: с FeCI3 с Br2/H2O c РСI5
- 51. Скачать презентацию















 Полифенолды қосылыстар. Флавоноидтар
Полифенолды қосылыстар. Флавоноидтар Фазовое равновесие
Фазовое равновесие Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7
Основы термической и химико-термической обработки стали. Теория и технология термической обработки стали. Лекция 3. Тема 7 Хром. Физические свойства и применение
Хром. Физические свойства и применение Валентность и степень окисления
Валентность и степень окисления Минералы и горные породы
Минералы и горные породы Алюминий и его соединения
Алюминий и его соединения Закон постоянства состава. Молекулярная формула вещества
Закон постоянства состава. Молекулярная формула вещества Агрегатное состояние веществ и типы химических связей
Агрегатное состояние веществ и типы химических связей Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Азотная кислота и ее соли. 9 класс
Азотная кислота и ее соли. 9 класс Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Спирты
Спирты Оксиды углерода
Оксиды углерода Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация
Коллоидные ПАВ. Мицеллообрaзование в растворах коллоидных ПАВ. Солюбилизация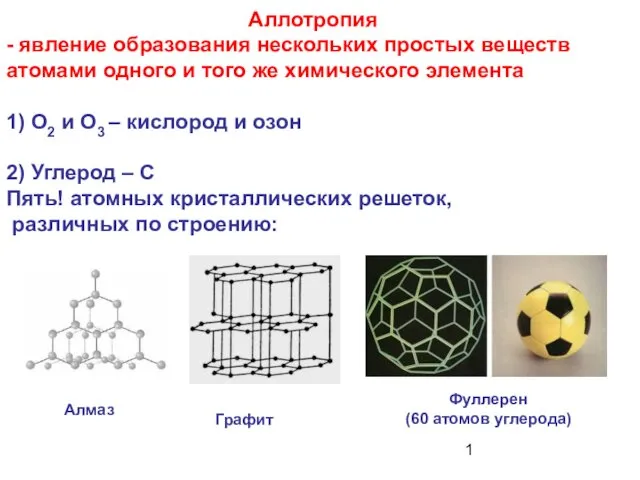 Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента
Аллотропия - явление образования нескольких простых веществ атомами одного и того же химического элемента Соли. 11 класс
Соли. 11 класс Аминокислоты
Аминокислоты Органические и неорганические кислоты
Органические и неорганические кислоты Отложения и коррозия
Отложения и коррозия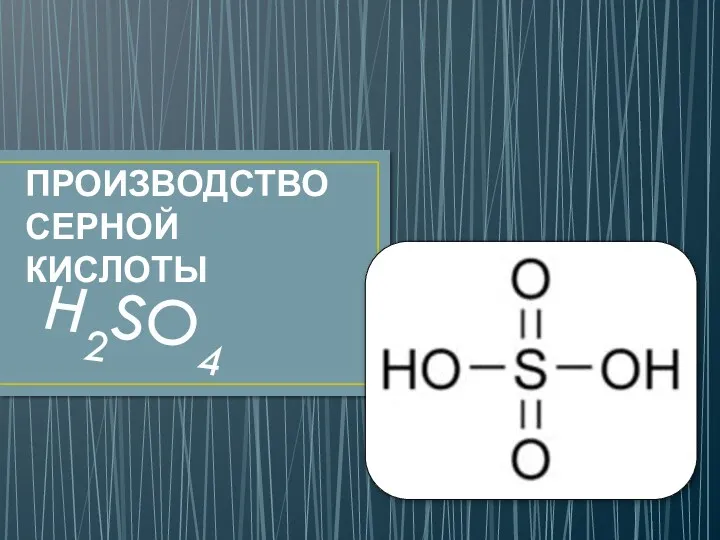 Производство серной кислоты
Производство серной кислоты Метод молекулярных орбиталей
Метод молекулярных орбиталей Водород. Общая характеристика, нахождение в природе. Получение и физические свойства
Водород. Общая характеристика, нахождение в природе. Получение и физические свойства Кисень та хімічні властивості кисню. 7 клас
Кисень та хімічні властивості кисню. 7 клас Химические свойства воды
Химические свойства воды Состав, строение и свойства аминокислот
Состав, строение и свойства аминокислот Сера
Сера Теория твердения минеральных вяжущих веществ
Теория твердения минеральных вяжущих веществ