Содержание
- 2. План лекции 1. Основные понятия 2. Классификация процессов 3. Скорость химической реакции 4. Влияние концентрации реагента
- 3. Химическая кинетика - раздел химии, изучающий скорость и механизмы химических реакций Термодинамика - наука о макросистемах
- 4. Классификация процессов по фазовому составу 1) гомогенные - протекающие по всему объему реагирующих веществ 2) гетерогенные
- 5. Молекулярность реакций По числу молекул одновременно участвующих в хим. превращении простые реакции делятся на: Мономолекулярные N2O4
- 6. Скорость химической реакции это число элементарных актов взаимодействия, происходящих в единицу времени в единице объема для
- 7. Скорость как функция изменения концентрации Взаимодействия атомов и молекул фиксировать невозможно, поэтому о скоростях реакций судят
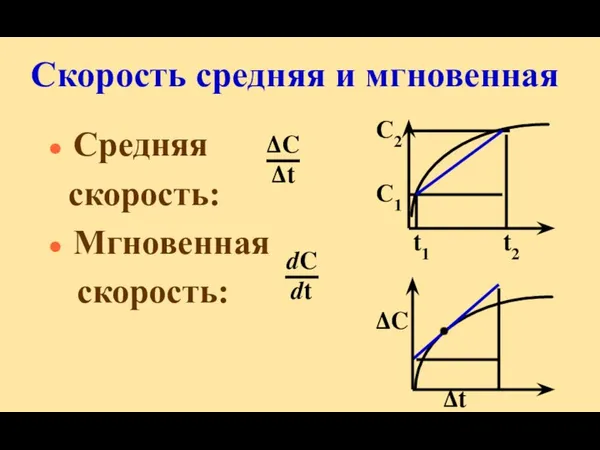
- 8. Скорость средняя и мгновенная Средняя скорость: Мгновенная скорость: С2 С1 t1 t2 ΔC Δt ΔC Δt
- 9. Для реакции в общем виде скорость химической реакции с учетом стех-ких коэффициентов: aA + bB =
- 10. Факторы, влияющие на скорость реакции Природа Концентрация веществ Температура Катализаторы На скорость гетерогенных р-ций кроме того
- 11. Влияние природы и концентрации реагентов на скорость реакций Закон действующих масс К. Гульдберг, П. Вааге (1867),
- 12. В общем случае: aA + bB + dD + ..... V = kC ⋅ C ⋅
- 13. Кинетическое уравнение Для простой реакции: аА + bВ = сС +dD математическое выражение ЗДМ: V =
- 14. Пример записи кинетического уравнения простой реакции 1) C2H5OH = C2H4 + H2O V=kС(C2H5OH) 2) 2HI =
- 15. Кинетическое уравнение сложной реакции аА + bВ=сС + dD V = k C C m и
- 16. Пример: Реакцию 2H2(г) + O2(г) = 2H2O(г) провели при одном давлении, а затем при давлении в
- 17. Скорость гетерогенных реакций зависит от удельной поверхности и концентраций реагентов в газовой фазе или в растворе
- 18. Уд. поверхность по ходу реакции мало изменяется , поэтому ее объединяют с конст. скорости р-ции Пример:
- 19. Константа равновесия с позиции кинетики Для простой обратимой реакции: аА+bВ сС+dД V = Vпр–Vобр = kпрC
- 20. Зависимость скорости от температуры (Правило Вант-Гоффа) При увеличении температуры на 10 градусов скорость простой реакции возрастает
- 21. Теория активации Аррениуса Хим. реакция может происходить только при столкновении активных частиц, т.е. тех, которые обладают
- 22. Энергия активации (Еа, кДж/моль) – это избыточный запас энергии молекулы над средне статистическим запасом энергии, позволяющий
- 23. Cогласно молекулярно-кинетической теории газов для каждой системы существует порог энергии Еа , начиная с которого энергия
- 24. Еа - велика, скорость реакции – мала Еа – мала, скорость – велика Уравнение Аррениуса
- 25. Определение энергии активации
- 26. Катализ
- 27. Катализ – это явление ускорения реакции под действием веществ не расходующихся в реакции Каталитические реакции –
- 28. Катализатор – это вещество, которое многократно участвует в промежуточных стадиях реакции, но выходит из нее химически
- 29. Гомогенный катализ (кат-р и реагент образуют одну фазу) Пример: получение SO3 окислением SO2 в технологии получения
- 31. Скачать презентацию



























 Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов
Классификация нефтей и товарных нефтепродуктов. Основные свойства нефтепродуктов Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Применение серной кислоты
Применение серной кислоты Химический элемент водород
Химический элемент водород Кинетика процессов твердофазного взаимодействия
Кинетика процессов твердофазного взаимодействия Биохимия. Лекция 7. Углеводы
Биохимия. Лекция 7. Углеводы Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Химический состав пресных вод рыбохозяйственного назначения
Химический состав пресных вод рыбохозяйственного назначения Нефть и нефтеподукты
Нефть и нефтеподукты Связующие для полимерных композиционных материалов. (Тема 2)
Связующие для полимерных композиционных материалов. (Тема 2) Геохимия изотопов стабильных элементов
Геохимия изотопов стабильных элементов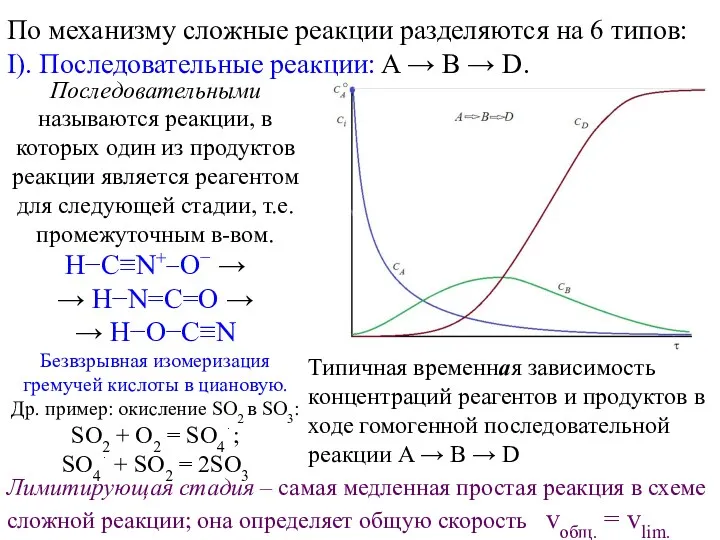 Сложные реакции по механизму
Сложные реакции по механизму Серная кислота и ее соли
Серная кислота и ее соли Природные источники углеводородов
Природные источники углеводородов Элемент, имеющий относительную атомную массу
Элемент, имеющий относительную атомную массу Дифузія в побуті
Дифузія в побуті Швидкість хімічної реакції
Швидкість хімічної реакції Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5
Электролитическая диссоциация. Протолитическая теория кислот и оснований. Лекция №5 Химические свойства алканов
Химические свойства алканов Химический элемент - водород
Химический элемент - водород Аминокислоты. Химические свойства
Аминокислоты. Химические свойства Химическая посуда и ее назначения (5)
Химическая посуда и ее назначения (5) Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева алканы 170
алканы 170 Петрология. Классификации магматических горных пород
Петрология. Классификации магматических горных пород Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения
Растворимость, ее зависимость от разных факторов. Насыщенные и ненасыщенные растворы. Физико-химическая сущность растворения Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1)
Воздушные вяжущие вещества. Гипсоангидритовые вяжущие вещества. Основы процессов схватывания и твердения. (Лекция 1) Пропилен-алкены(пропен)
Пропилен-алкены(пропен)