Содержание
- 2. В соединениях фосфор способен проявлять степень окисления –3 (в соединениях фосфора с металлами — фосфидах), но
- 3. Аллотропные модификации фосфора Materialscientist
- 4. Белый фосфор Белый фосфор представляет собой легкоплавкое, летучее вещество, нерастворимое в воде, но хорошо растворимое в
- 5. Белый фосфор м Белый фосфор очень ядовит, легко окисляется на воздухе. Особым его свойством является способность
- 6. Красный фосфор Красный фосфор — порошкообразное вещество тёмно-красного цвета, без запаха, не растворяется в воде и
- 7. Чёрный фосфор Поджечь чёрный фосфор можно, только предварительно сильно раскалив в атмосфере чистого кислорода до 400
- 8. Красный и черный фосфор обладают очень сложной структурой, поэтому в уравнениях реакций их формулу записывают просто
- 9. Белый фосфор и красный фосфор обладают схожими химическими свойствами, однако белый обладает большей реакционной способностью.
- 10. При взаимодействии фосфора с металлами образуются фосфиды. 2Р + 3Са = Са3Р2
- 11. Окисление фосфора кислородом 4Р + 5О2 = 2Р2О5
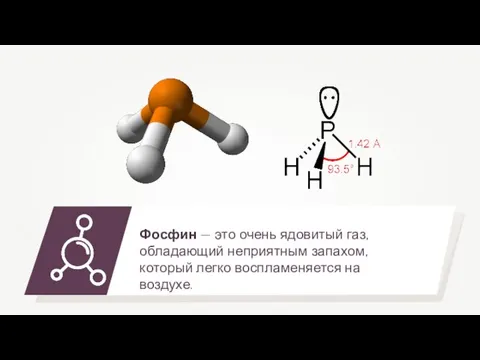
- 12. Получение фосфина РН3 Са3Р2 + 6НСl = 3CaCl2 + 2PH3↑
- 13. Фосфин — это очень ядовитый газ, обладающий неприятным запахом, который легко воспламеняется на воздухе.
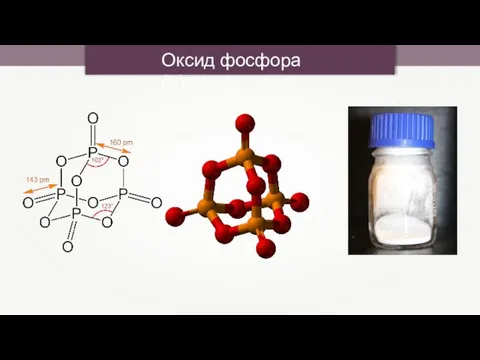
- 14. Оксид фосфора (V)
- 15. Химические свойства Р2О5 1.Взаимодействует с водой с образованием кислоты: Р2О5 + 3Н2О = 2Н3РО4 2. Взаимодействует
- 16. Фосфорная кислота Н3РО4 — твёрдое, прозрачное, кристаллическое вещество, которое хорошо растворяется в воде в любых соотношениях.
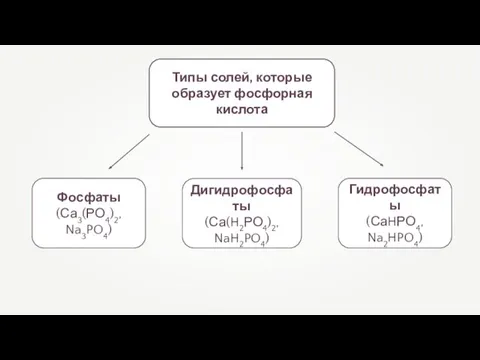
- 17. Типы солей, которые образует фосфорная кислота
- 18. Качественным реактивом на фосфаты РО43- является нитрат серебра AgNO3. РО43- + 3Ag = Ag3PO4↓ жёлтый осадок
- 19. Фосфор в природе Фосфориты Апатиты Фосфор в природе
- 20. В промышленности фосфор получают из наиболее часто встречающегося фосфата кальция Ca3(PO4)2.
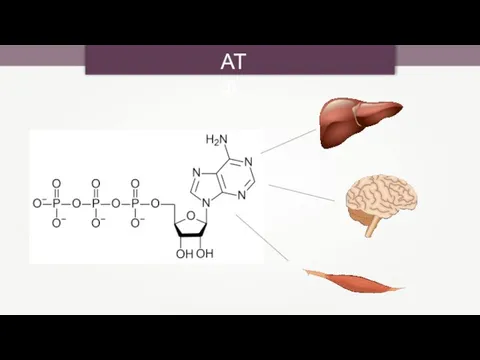
- 21. АТФ
- 22. ДНК РНК
- 24. Применение фосфора Спички Фосфорная кислота
- 26. Скачать презентацию


















 Свойства простых веществ в свете ОВР
Свойства простых веществ в свете ОВР История открытия периодической системы химических элементов Д.И. Менделеева
История открытия периодической системы химических элементов Д.И. Менделеева Чистые вещества и смеси
Чистые вещества и смеси Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати
Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати Теория строения органических соединений А.М. Бутлерова
Теория строения органических соединений А.М. Бутлерова Кислородсодержащие соединения серы. Оксиды, кислоты, соли
Кислородсодержащие соединения серы. Оксиды, кислоты, соли Классификация и номенклатура органических соединений
Классификация и номенклатура органических соединений Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Азот и его соединения
Азот и его соединения История открытия химических веществ
История открытия химических веществ Спирти. Історична довідка
Спирти. Історична довідка Вода - основа жизни
Вода - основа жизни Карбоновые кислоты
Карбоновые кислоты Protein and amino acid metabolism
Protein and amino acid metabolism Теория резонанса в неорганической химии
Теория резонанса в неорганической химии Степени окисления атомов и формулы веществ
Степени окисления атомов и формулы веществ Решение заданий ЕГЭ на составление окислительно-восстановительных реакций
Решение заданий ЕГЭ на составление окислительно-восстановительных реакций Метали IV групи побічної підгрупи (Ti, Zr, Hf)
Метали IV групи побічної підгрупи (Ti, Zr, Hf) Автомобильные бензины
Автомобильные бензины Бор и его соединения
Бор и его соединения Хімічний зв’язок
Хімічний зв’язок Ароматы, запахи, флюиды
Ароматы, запахи, флюиды Золото. История открытия
Золото. История открытия Элементы кристаллохимии
Элементы кристаллохимии Искусственные полимеры. 10 класс
Искусственные полимеры. 10 класс Монокристаллы InSb. Свойства, выращивание, применение
Монокристаллы InSb. Свойства, выращивание, применение Решение задачи №10. Гидроксид рубидия. Команда Карбораны
Решение задачи №10. Гидроксид рубидия. Команда Карбораны Генетическая связь между классами неорганических соединений. Урок 1
Генетическая связь между классами неорганических соединений. Урок 1