Содержание
- 2. Химические реакции - это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них
- 3. Классификация По числу и составу реагирующих веществ По изменению степени окисления химических элементов, образующих вещества По
- 4. По числу и составу реагирующих веществ Реакции, идущие без изменения состава веществ Реакции, идущие с изменением
- 5. По изменению степени окисления Окислительно-восстановительные Реакции, идущие без изменения степеней окисления химических элементов
- 6. По тепловому эффекту Экзотермические Эндотермические
- 7. По агрегатному состоянию реагирующих веществ Гомогенные Гетерогенные
- 8. По участию катализатора Каталитические Некаталитические
- 9. По направлению Необратимые Обратимые
- 10. Получение аллотропных модификаций C (графит) C (алмаз)
- 11. С изменением состава Соединения Разложения Замещения Обмена
- 12. Реакции соединения – из двух и более веществ образуется одно более сложное 2H2 + O2 2H2O
- 13. Реакции разложения – из одного вещества образуется два и более 2HgO 2Hg + O2 2KNO3 2KNO2
- 14. Реакции замещения – атомы простого вещества замещают атомы в сложном веществе Mg + 2HCl MgCl2 +
- 15. Реакции обмена – вещества обмениваются своими составными частями CO2+Ca(OH)2 CaCO3 +H2O K2S + 2HCl H2S +
- 16. Окислительно-восстановительные реакции 0 0 +4 -2 C + O2 CO2 0 +4 C – 4e C
- 17. Реакции протекающие без изменения степени окисления + -2 + -2 + -2 + Li2O + H2O
- 18. Экзотермические - реакции протекающие с выделением теплоты 4P + 5O2 2P2O5 + Q CH4+2O2 CO2+2H2O +
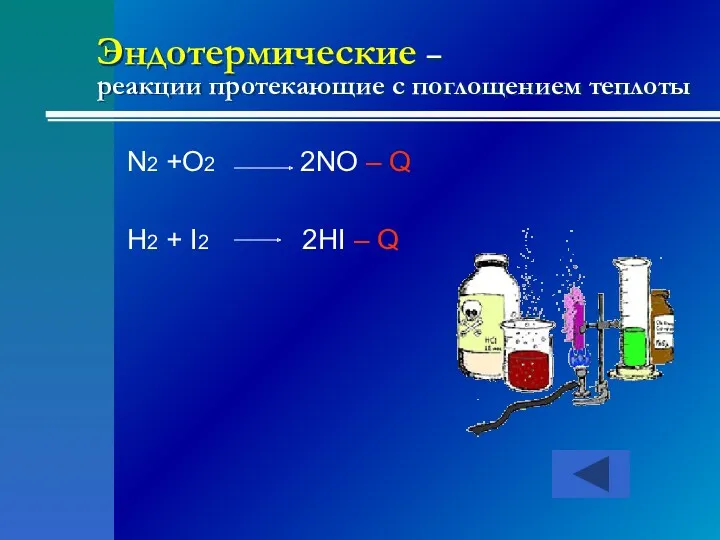
- 19. Эндотермические – реакции протекающие с поглощением теплоты N2 +O2 2NO – Q H2 + I2 2HI
- 20. Гомогенные – реакции в которых исходные вещества и продукты реакции находятся в одном агрегатном состоянии H2
- 21. Гетерогенные - реакции в которых исходные вещества и продукты реакции находятся в разных агрегатных состояниях Ca(т)
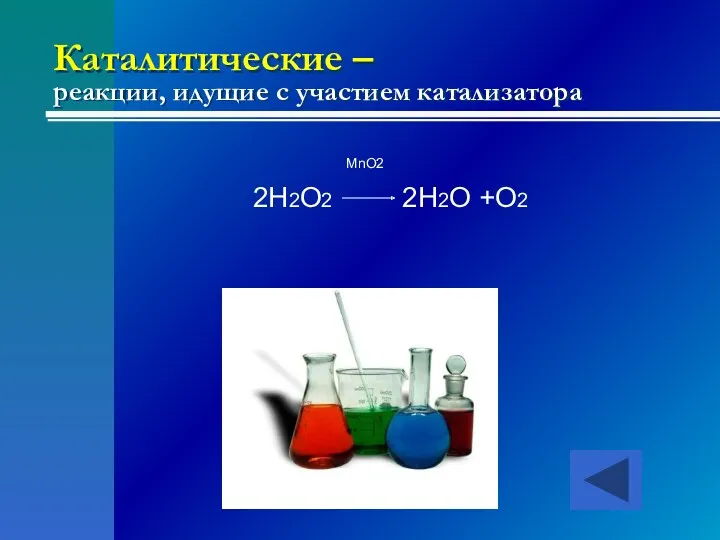
- 22. Каталитические – реакции, идущие с участием катализатора MnO2 2H2O2 2H2O +O2
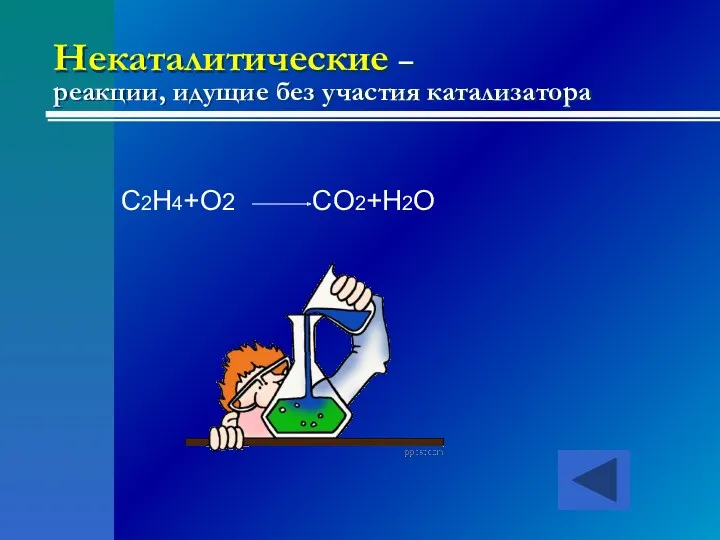
- 23. Некаталитические – реакции, идущие без участия катализатора C2H4+O2 CO2+H2O
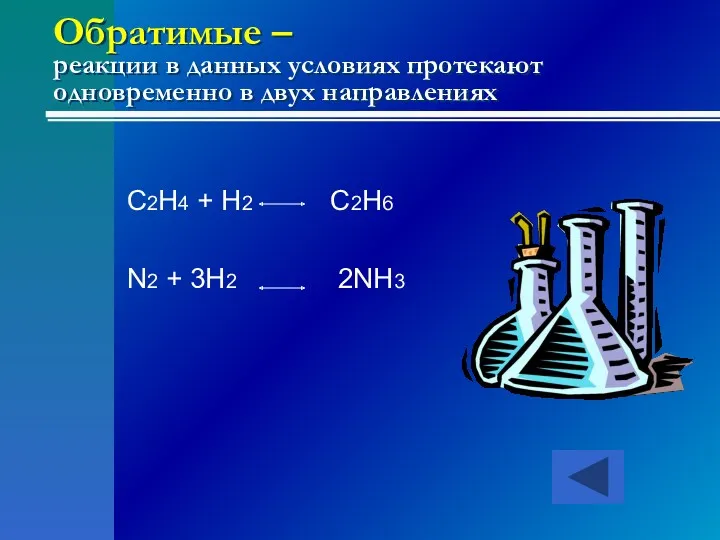
- 24. Обратимые – реакции в данных условиях протекают одновременно в двух направлениях C2H4 + H2 C2H6 N2
- 25. Необратимые – реакции в данных условиях протекают только в одном направлении H2SO4+BaCl2 BaSO4 + 2HCl 2Na+2H2O
- 26. Составим характеристику процесса синтеза аммиака 0 0 Fe – 3 + N2 (г) + 3H2 (г)
- 27. Вывод: Классификация химических реакций условна. Ученые договорились разделить реакции на определенные типы по выделенным признакам Большинство
- 29. Скачать презентацию






















 Эндогенная серия. Альбитит-грейзеновая группа
Эндогенная серия. Альбитит-грейзеновая группа Виды коррозии
Виды коррозии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Нуклеин қышқылдары
Нуклеин қышқылдары Ртуть. Использование ртути
Ртуть. Использование ртути Художественная обработка камня
Художественная обработка камня Introduction to effective permeability and relative permeability
Introduction to effective permeability and relative permeability Кристаллическое состояние вещества
Кристаллическое состояние вещества Биохимия нуклеиновых кислот
Биохимия нуклеиновых кислот Химические чистящие средства
Химические чистящие средства Химические вещества как строительные и поделочные материалы
Химические вещества как строительные и поделочные материалы Вода - уникальнейшая структура жизни. Способы ее очистки
Вода - уникальнейшая структура жизни. Способы ее очистки Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9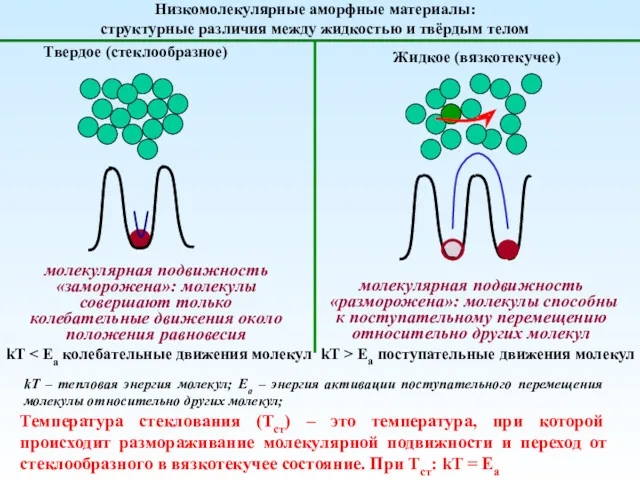 Механика полимеров
Механика полимеров Карбоновые кислоты. (10 класс)
Карбоновые кислоты. (10 класс) Химические реакции. Условия необходимые для протекания химических реакций?
Химические реакции. Условия необходимые для протекания химических реакций? Петрография
Петрография Смоги и их влияние на человека
Смоги и их влияние на человека Валентные возможности атомов. Степень окисления
Валентные возможности атомов. Степень окисления Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Алюминий (лат. Aluminium)
Алюминий (лат. Aluminium) Качественные реакции на функциональные группы. Классификация функциональных групп
Качественные реакции на функциональные группы. Классификация функциональных групп Биологически важные реакции карбонильных соединений. Масс-спектрометрия
Биологически важные реакции карбонильных соединений. Масс-спектрометрия Металлы. Общая характеристика
Металлы. Общая характеристика Минералогия литофильных редких элементов. Бор
Минералогия литофильных редких элементов. Бор Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД)