Слайд 2

Записать формулы:
Оксид магния –
Оксид серы (IV) -
Гидроксид алюминия -
Соляная кислота -
Гидроксид калия -
Серная кислота –
Слайд 3

Ответы
−MgO,
– SO2,
– Al(OH)3,
−HCl,
−KOH,
−H2SO4
Слайд 4

Расклассифицируйте вещества по классам: oксиды, кислоты, основания
P2O5, NaСI, CuOН, Са3(РО4)2
, HNO3,
Ba(OH)2, MgO, H2SO4, KOН, SO3, CaCO3
Слайд 5

Соли. Классификация.
Физические и химические свойства. Получение и применение солей.
Слайд 6
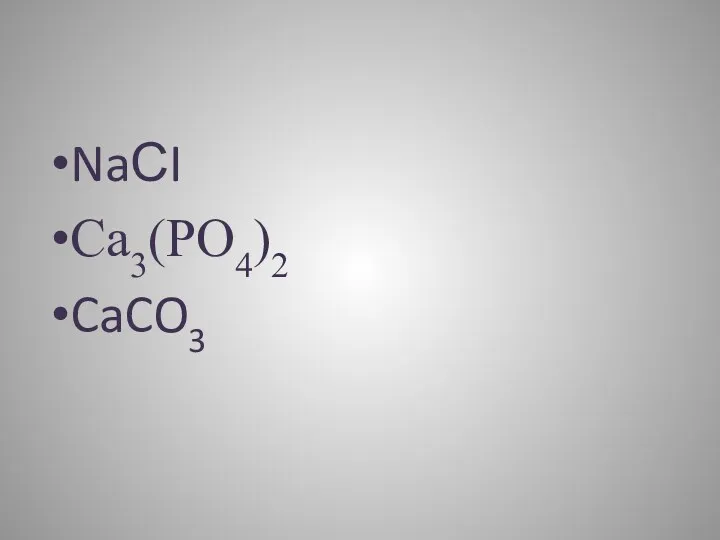
Слайд 7

Что такое соли?
Соли–это сложные вещества, образованные атомами металлов и кислотными
остатками
NaСI
Са3(РО4)2
CaCO3
Слайд 8

Номенклатура солей
Название Название Указание
Кислотного + металла (в Р.п.) + валентности
остатка
NaCl
хлорид натрия
CaCO3 карбонат кальция
Са3(РО4)2 фосфат кальция
МgCI2 хлорид магния
Слайд 9

Попробуйте сами дать названия следующим солям:
KCI
CaCI2
NaСI
Са3(РО4)2
CaCO3
BaCO3
Слайд 10
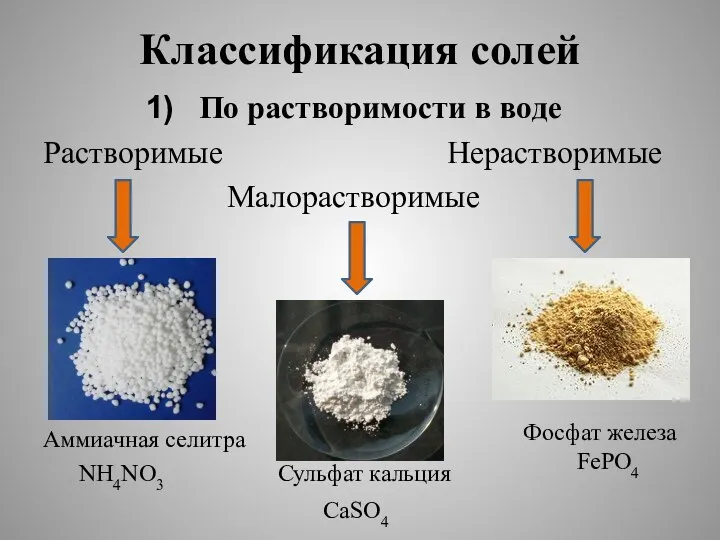
Классификация солей
По растворимости в воде
Растворимые Нерастворимые
Малорастворимые
Аммиачная селитра
NH4NO3 Сульфат кальция
Фосфат
Слайд 11
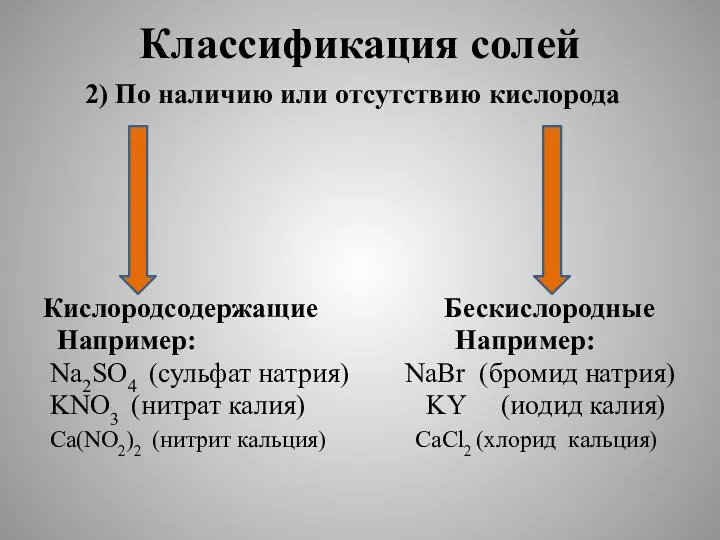
Классификация солей
2) По наличию или отсутствию кислорода
Кислородсодержащие Бескислородные
Например: Например:
Na2SO4 (сульфат натрия) NaBr (бромид натрия)
KNO3 (нитрат калия) KY (иодид калия)
Ca(NO2)2 (нитрит кальция) CaCl2 (хлорид кальция)
Слайд 12
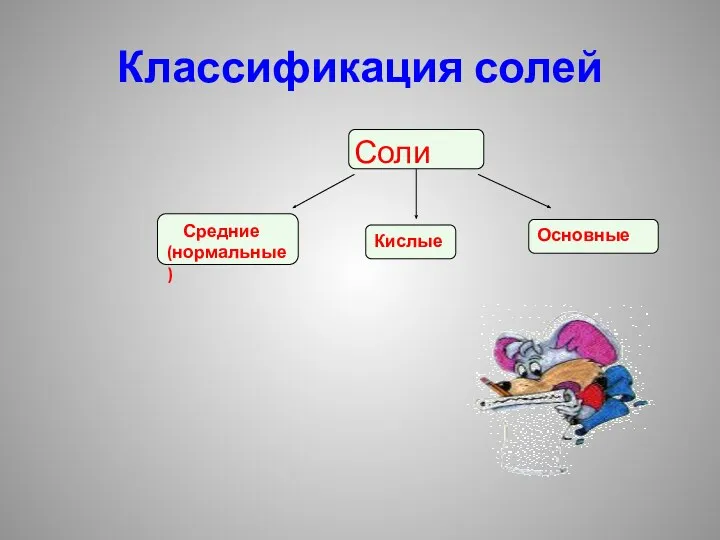
Классификация солей
Соли
Средние (нормальные)
Кислые
Основные
Слайд 13

Разновидности солей
Соли бывают:
Средние соли – это продукты полного замещения атомов водорода
в кислоте на металл.
Например: Na2CO3 (карбонат натрия)
CuSO4 (сульфат меди)
Слайд 14

Разновидности солей
2) Кислые соли – это продукты неполного замещения атомов
водорода в кислоте на металл.
Например:
NaHCO3 (гидрокарбонат натрия)
Mg(HSO4)2 (гидросульфат магния)
Слайд 15

Разновидности солей
3) Основные соли – это продукты неполного замещения гидроксогрупп
в основании на кислотный остаток.
Например:
(CuOH)2CO3 (гидроксокарбонат меди (II))
AlOHCl2 (гидроксохлорид алюминия)
Слайд 16

Физические свойства:
Все соли твердые кристаллические вещества. Соли имеют различную окраску, и
разную растворимость в воде.
Слайд 17

Химические свойства
Соль + кислота = другая соль + другая кислота
Например: H2SO4
+ BaCl2 = BaSO4 +2HCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 18
Химические свойства
2) Соль + щелочь = другая соль + другое основание
Например:
NaOH + NH4Cl = NaCl + NH3 + H2O
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок или газ.
Слайд 19

Химические свойства
3) Соль1 + соль2 = соль3 + соль4
Например:
Na2SO4 + BaCl2 = BaSO4 +2NaCl
Типичная реакция ионного обмена, протекающая только в том случае, если образуется осадок.
Слайд 20

Химические свойства
4) Соль + металл = другая соль + другой металл
Например:
CuSO4(p-p) + Fe = FeSO4 (p-p) + Cu
Правила: а) Каждый металл вытесняет из растворов солей все другие металлы, расположенные правее его в ряду напряжений;
б) обе соли (и реагирующая, и образующаяся в результате реакции) должны быть растворимыми;
в) металлы не должны взаимодействовать с водой, поэтому металлы главных подгрупп I и II группы ПС Д.И.Менделеева не вытесняют другие металлы из растворов солей.
Слайд 21

Получение солей:
1. Взаимодействие кислоты с Ме:
Zn + 2HCI
→ ZnCI2 + H2
2. Взаимодействие кислоты с основными оксидами:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3 H2O
3. Взаимодействие кислотного оксида со щёлочью:
N2O5 + Ca(OH)2 →Ca(NO3)2 + H2O
4. Взаимодействие кислотного оксида с основным оксидом:
SiO2 + CaO → CaSiO3
5. Взаимодействие металла с неметаллом:
2Fe + 3CI2 → 2FeCI3
Слайд 22

Применение солей
- в стирке, с помощью порошка, с состав которого входит
стиральная (кальцинированная) сода – Na2CO3;
- удобрения, которые мы вносим в почву – NH4NO3- аммиачная селитра; CaHPO4- простой суперфосфат и другие.
- в домашней аптечке – ляпис AgNO3
- СuSO4- медный купорос, который добавляют в побелку, применяют против болезней и вредителей растений.
да и сам наш организм содержит соли, в костях – Ca3(PO4)2
Слайд 23

Слайд 24

Слайд 25

Обобщение темы
Тест «Как я запомнил тему»:
1) Выберите формулу соли:
а) HCl б) Ca(OH)2
в)
Na2SO4 г) MgО
2) Какая из приведенных солей растворима в воде:
а) AgCl б) MgS
в) FePO4 г) CuSO4
3) Какая из приведенных солей бескислородная:
а) CаSO4 б) KBr
в) NH4NO3 г) Na2CO3
Слайд 26

.
4) К какому типу солей относится данная соль - AlOHCl2:
а) средняя б)
основная
в) кислая г) ни к одной из этих
5) Какая реакция не является типичной реакцией для средних солей:
а) соль + металл б) соль + кислота
в) соль + оксид г) соль + щелочь
Слайд 27

Ответы:
1. в
2. г
3. б
4. б
5. в
Слайд 28




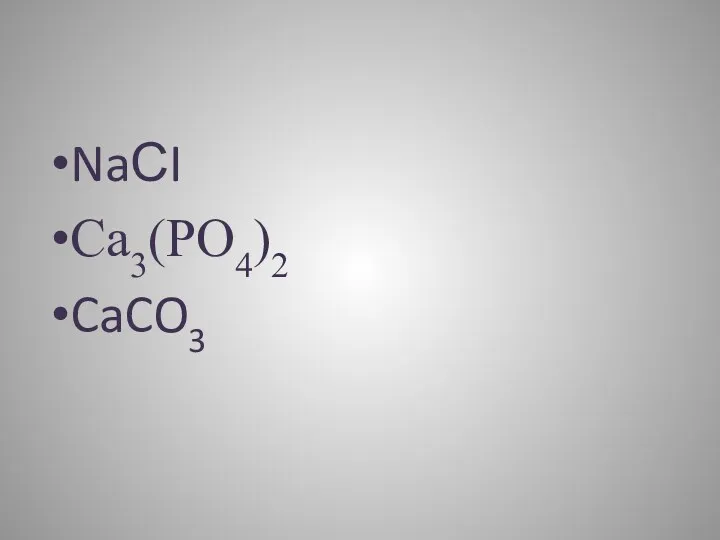






















 Принципы наноармирования волокнистых композитов
Принципы наноармирования волокнистых композитов Литий. Физические и химические свойства. Получение и применение
Литий. Физические и химические свойства. Получение и применение Электролиз
Электролиз Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні
Органикалық қышқылдарды алу. Тамақ өнеркәсібіндегі органикалық қышқылдардың тәжірибелік мәні Вольтамперометрические методы анализа
Вольтамперометрические методы анализа Ископаемые углеводороды
Ископаемые углеводороды Минералогический состав почв
Минералогический состав почв Гидролиз солей. Лекция №9
Гидролиз солей. Лекция №9 IV группа главная подгруппа
IV группа главная подгруппа Омыватель лобового стекла автомобиля
Омыватель лобового стекла автомобиля Реактор получения элементарной серы
Реактор получения элементарной серы Введение в химию. 8 класс
Введение в химию. 8 класс Щелочные металлы
Щелочные металлы От алхимии к химии
От алхимии к химии 5-я группа элементов
5-я группа элементов Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Основные виды сырья для производства строительных материалов. Лекция 4
Основные виды сырья для производства строительных материалов. Лекция 4 Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева
Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева Алкилирование изобутана олефинами
Алкилирование изобутана олефинами Углерод. Элемент IV группы
Углерод. Элемент IV группы Оксиды, их классификация и свойства (8 класс)
Оксиды, их классификация и свойства (8 класс) Соединения железа
Соединения железа Кремний и его соединения
Кремний и его соединения Полимеры. Степень полимеризации
Полимеры. Степень полимеризации Роль хімії в природі
Роль хімії в природі Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины
Предельные углеводороды. Насыщенные алифатические углеводороды. Алканы или Парафины Химические соединения в организме человека
Химические соединения в организме человека 20230419_eds
20230419_eds