Содержание
- 2. Соединения железа (II) Оксид железа (II) FeO Оксид железа (II) — черный порошок. Применяется как компонент
- 3. Оксид железа (II) FeО солеобразующий, основный Перечислите свойства характерные для основных оксидов. 1. Взаимодействует с соляной
- 4. Оксид железа (III) Fe2О3 Оксид железа (III) — порошок красно-коричневого цвета. В природе — оксидные руды
- 5. Оксид железа (III) проявляет слабые амфотерные свойства. Он хорошо растворяется в кислотах с образованием солей. Fe2O3
- 6. Гидроксид железа (II) Fe(OH)2 Гидроксид железа (II) обладает основными свойствами. Белый (иногда с зеленоватым оттенком). Термически
- 7. Составьте уравнения реакций гидроксида железа (II) с соляной кислотой. Рассмотрите реакцию с точки зрения ТЭД. Fe(OH)2
- 8. Гидроксид железа (III) Fe(OH)3 Гидроксид железа (III) проявляет слабоамфотерные свойства. Светло-коричневый. При нагревании разлагается без плавления.
- 9. Гидроксид железа (III) можно получить обменной реакцией между растворимой в воде солью железа (III) и щелочью.
- 10. Качественные реакции на железо (III) Ионы железа (III) в растворе можно определить с помощью качественных реакций.
- 11. Качественные реакции на железо (II) 2. Качественная реакция на ион железа (II) – реакция с красной
- 12. 1. При травлении плат в электротехнике используют раствор хлорного железа (хлорида железа (III)). Этот реактив растворяет
- 14. Скачать презентацию











 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов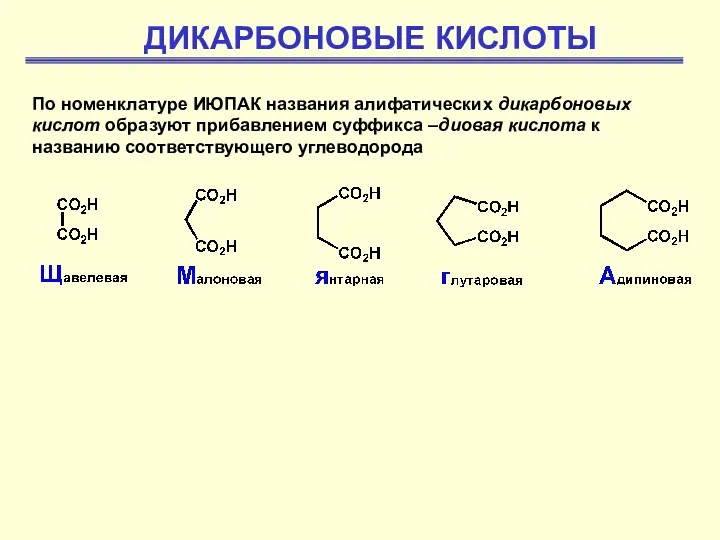 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка