Содержание
- 2. Цели урока: Сформировать понятия о кристаллическом и аморфном состоянии твердых тел Дать представления о типах кристаллических
- 3. Таблица агрегатных состояний вещества 26.12.18
- 4. Твердые вещества характеризуются: расстояние между частицами (молекулами, ионами, атомами) очень мало; движение частиц вещества ограничено, притяжение
- 5. аморфные (греч. а- частица отрицания, morphe –вид, форма) кристаллические (греч. krystallos – лед, горный хрусталь) Твердые
- 6. Признаки аморфных веществ излом ограничен овальными поверхностями; нет определенной температуры плавления; при нагревании размягчаются, теряют форму,
- 7. Аморфные вещества 26.12.18
- 8. Кристаллические вещества имеют упорядочную структуру; кристаллы имеют определенную форму; анизотропны, т.е. их свойства по разным направлениям
- 9. Кристаллы являются предметом изучения наук: кристаллография - изучающая законы образования, морфологию, физические свойства кристаллов. кристаллохимия –
- 10. монокристаллы – это одиночные кристаллы (кварц, алмаз). поликристаллы – это твердое тело, состоящее из большого числа
- 11. Взаимосвязь кристаллических решеток, вида связи и свойств веществ 26.12.18
- 12. в узлах - противоположно заряженные ионы ионная в узлах – отдельные атомы атомная в узлах –
- 13. Ионная кристаллическая решетка очень прочная [Тпл (NaCl)=801°С] хрупкая 26.12.18
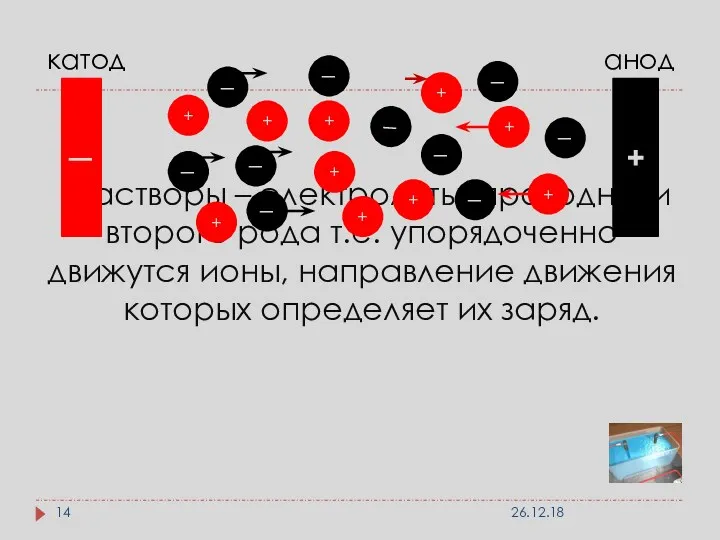
- 14. растворы – электролиты, проводники второго рода т.е. упорядоченно движутся ионы, направление движения которых определяет их заряд.
- 15. Ионная кристаллическая решетка виды частиц в узлах решетки: противоположно заряженные ионы; вид связи между частицами: электростатическое
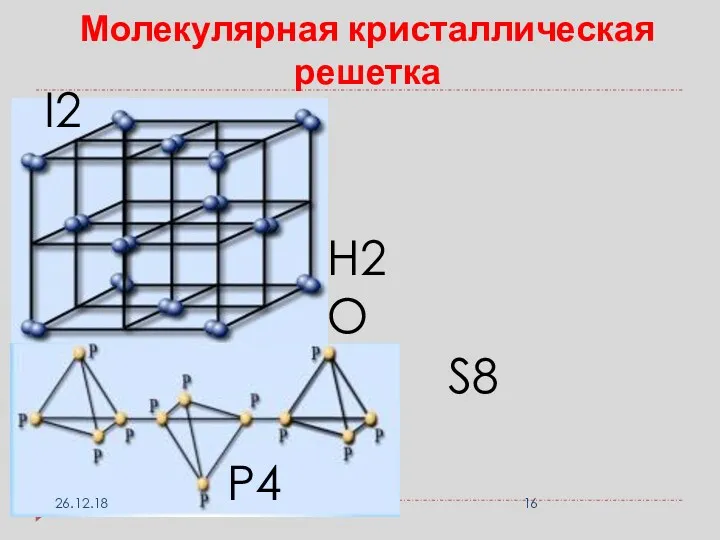
- 16. Молекулярная кристаллическая решетка I2 P4 S8 H2O 26.12.18
- 17. Молекулярная кристаллическая решетка Виды частиц в узлах решетки: молекулы; связи в молекулах прочные К.Х.С. Вид связи
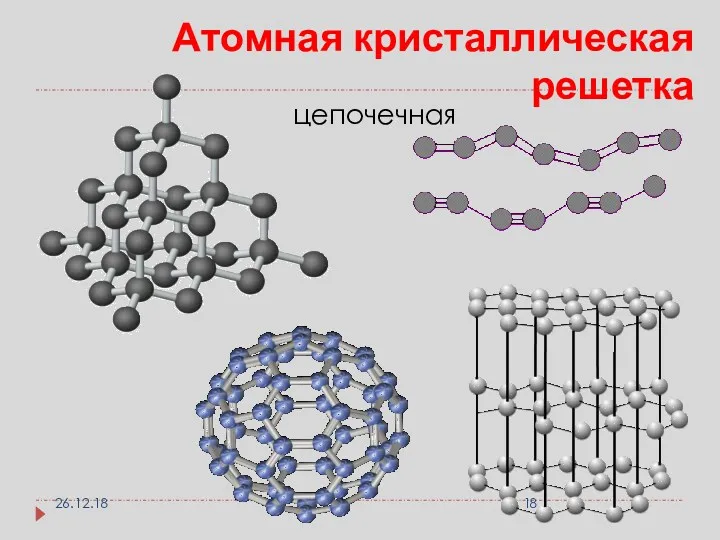
- 18. Атомная кристаллическая решетка цепочечная 26.12.18
- 19. Графен это такая форма углерода имеющая решетку толщиной всего в атом. обладает большой прочностью, гибкостью теплопроводностью,
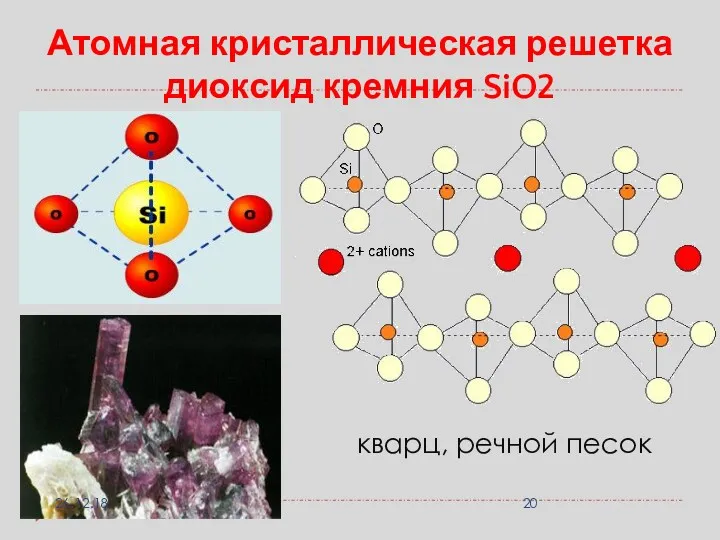
- 20. Атомная кристаллическая решетка диоксид кремния SiO2 кварц, речной песок 26.12.18
- 21. Атомная кристаллическая решетка корунда Al2O3 сапфиры, рубины -отличны лишь наличием различных примесей, которые придают им хар-ные
- 22. Атомная кристаллическая решетка Виды частиц в узлах решетки: отдельные атомы; Вид связи между частицами: соединены очень
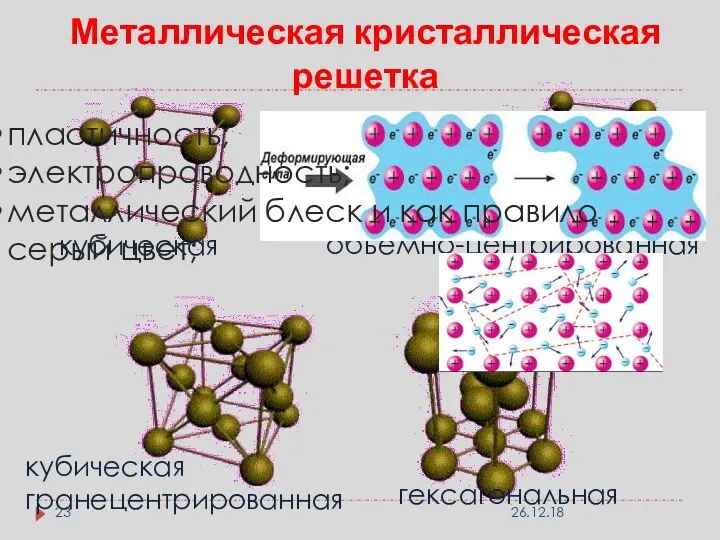
- 23. кубическая кубическая объемно-центрированная кубическая гранецентрированная гексагональная Металлическая кристаллическая решетка пластичность; электропроводность; металлический блеск и как правило
- 24. Металлическая кристаллическая решетка Виды частиц в узлах решетки: атом – ионы металлов; Вид связи между частицами:
- 25. Атомиум символ современного Брюсселя; спроектирован инженером Андре Ватеркейном к всемирной выставке в Брюсселе в 1958 году.
- 26. строение атома э/о атома вид химической связи тип кристаллической решетки свойства веществ Выводы: свойства веществ в
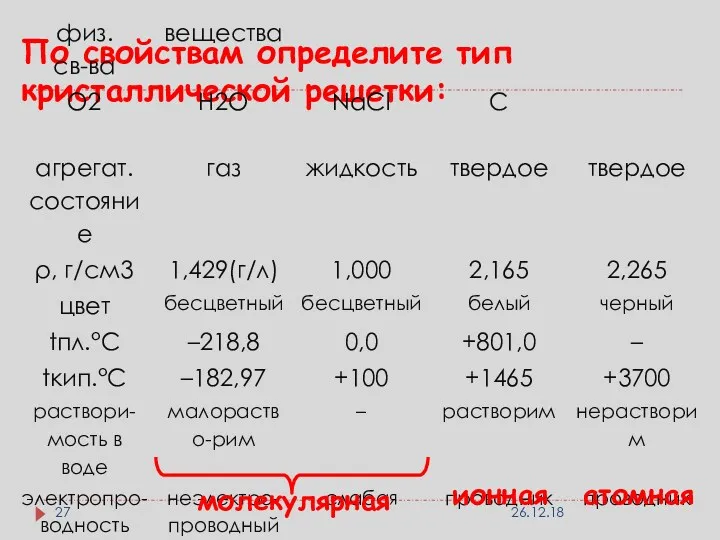
- 27. По свойствам определите тип кристаллической решетки: молекулярная ионная атомная 26.12.18
- 28. Зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку. 26.12.18
- 29. Зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку. 26.12.18
- 30. Закон постоянства состава вещества один из основных законов химии, сформулирован в 1799г Ж. Прустом: «Всякое чистое
- 31. Закон постоянства состава вещества в начале XIX века установил, что элементы могут соединяться друг с другом
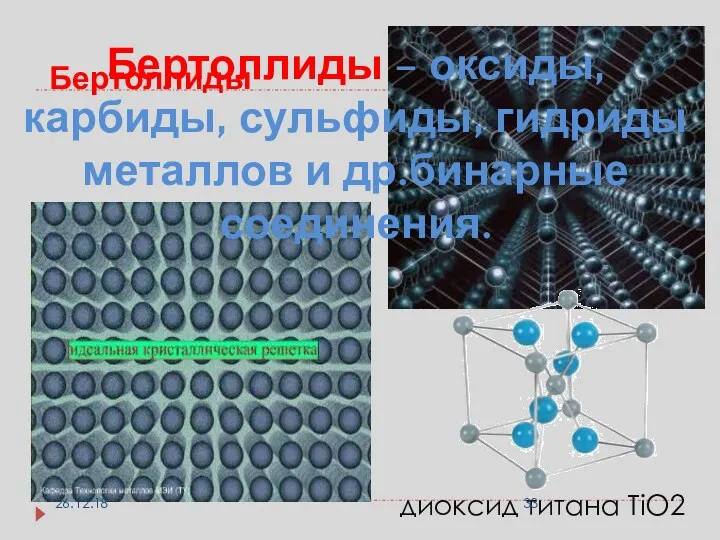
- 32. вещества бертоллиды - вещества немолекулярного строения (имеют переменный состав, который зависит от способа получения.) MnO2 →
- 33. диоксид титана TiO2 Бертоллиды Бертоллиды – оксиды, карбиды, сульфиды, гидриды металлов и др.бинарные соединения. 26.12.18
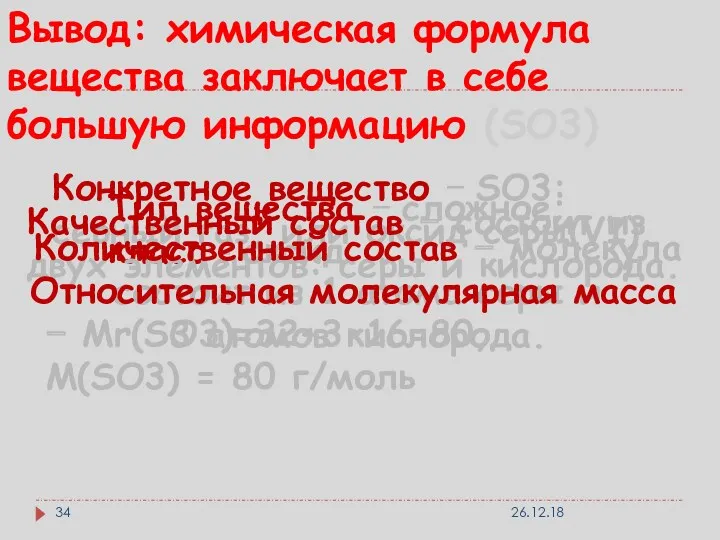
- 34. Вывод: химическая формула вещества заключает в себе большую информацию (SO3) Конкретное вещество − SO3: серный газ,
- 35. Подведение итогов занятия Какие классификации веществ вы узнали? Как вы понимаете термин кристаллическая решетка. В каком
- 36. Графический диктант «Виды химических связей и типы кристаллических решеток» I вариант: ионная связь II вариант: ковалентная
- 38. Скачать презентацию











![Ионная кристаллическая решетка очень прочная [Тпл (NaCl)=801°С] хрупкая 26.12.18](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/371660/slide-12.jpg)















 Хроматографические методы в радиохимии
Хроматографические методы в радиохимии Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Кислородные соединения азота
Кислородные соединения азота Минералы
Минералы Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Классификация химических реакций
Классификация химических реакций Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод
Гальванический элемент Даниэля-Якоби. Потенцометрия. Стеклянный электрод Гигиена питания школьников
Гигиена питания школьников Классификация химических реакций
Классификация химических реакций Көміртекті материалдар
Көміртекті материалдар Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы
Мұнай эмульсиясының құрамы және фаза аралық беттерінің құрылымы. Эмульсия инверсиясы Азот. Фосфор
Азот. Фосфор Теории кислот и оснований. Буферные системы крови
Теории кислот и оснований. Буферные системы крови Неметаллы
Неметаллы Фракционирование клеточных экстрактов
Фракционирование клеточных экстрактов Геохимия ландшафтов
Геохимия ландшафтов Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары
Улыхимикаттармен жұмыс жасау барысындағы қауіпсіздік шаралары Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Соли, их классификация и свойства в свете ТЭД
Соли, их классификация и свойства в свете ТЭД Фазовые равновесия. Физическая и коллоидная химия
Фазовые равновесия. Физическая и коллоидная химия Циклоалканы
Циклоалканы Нанопористые материалы
Нанопористые материалы Задачи и методы количественного анализа. Кислотно-основное титрование
Задачи и методы количественного анализа. Кислотно-основное титрование Золото (Au). Загальна характеристика
Золото (Au). Загальна характеристика Циклические углеводороды. Циклоалканы
Циклические углеводороды. Циклоалканы