Содержание
- 2. Химическая разминка Семен Исаакович Вольфкович (1896 – 1980 г.г.) в одной из лабораторий Московского университета на
- 3. Химическая разминка У Куртуа был любимый кот, который во время обеда сидел обычно на плече своего
- 4. Положение неметаллов в ПС Д.И.Менделеева. Строение атомов НеМе Неметаллы расположены в правом верхнем углу ПС (вдоль
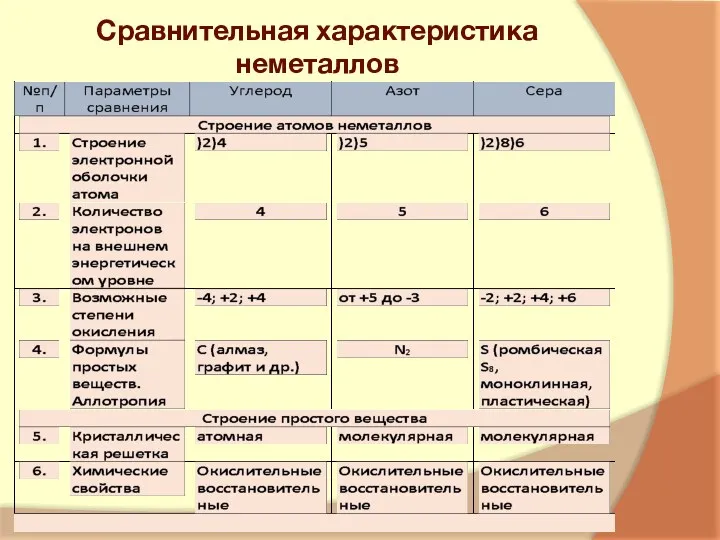
- 5. Сравнительная характеристика неметаллов
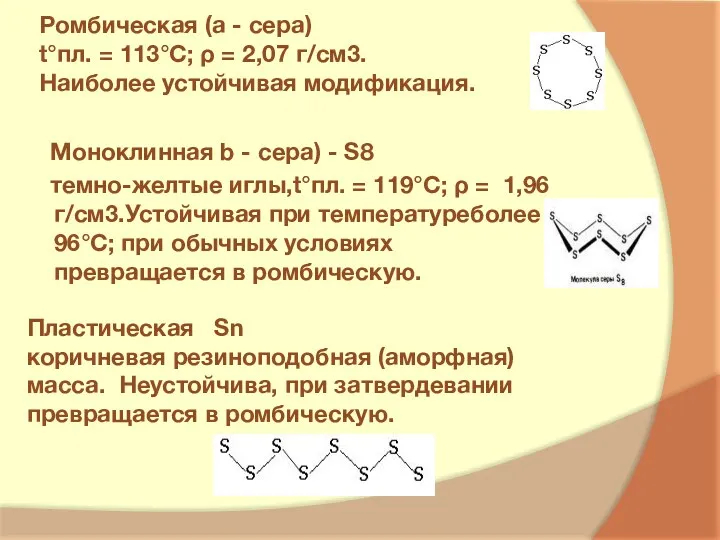
- 6. Ромбическая (a - сера) t°пл. = 113°C; ρ = 2,07 г/см3. Наиболее устойчивая модификация. Моноклинная b
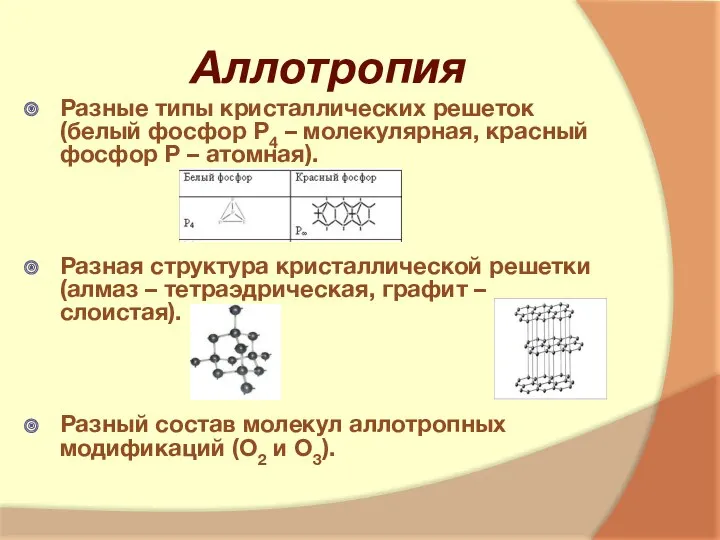
- 7. Аллотропия Разные типы кристаллических решеток (белый фосфор Р4 – молекулярная, красный фосфор Р – атомная). Разная
- 8. «А я люблю задачи» Рассчитайте, какой объем хлора потребуется для получения 1 кг поваренной соли.
- 9. «Генетичекий ряд неметалла» Пусть эти превращения Дадут вам уравнения. Красный фосфор я сжигаю, К дымку воду
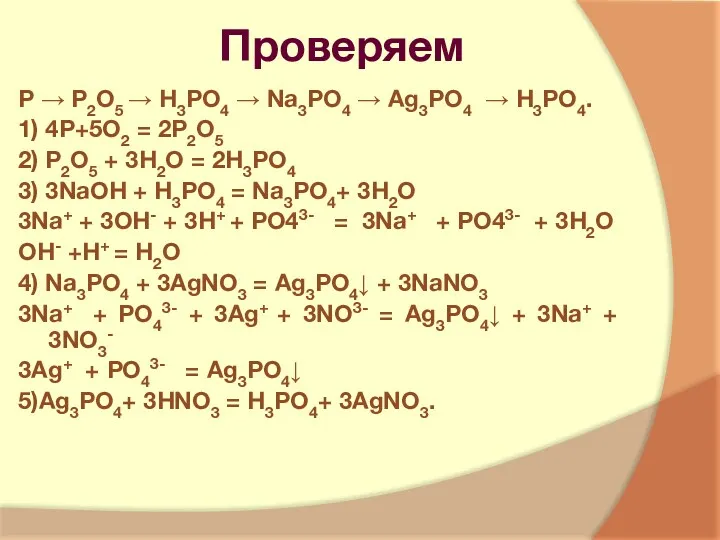
- 10. Проверяем Р → Р2О5 → Н3РО4 → Na3PO4 → Ag3PO4 → Н3РО4. 1) 4Р+5О2 = 2Р2О5
- 11. 4. «Ситуационное задание» Задание №1 Опоздав на занятия химического кружка, на котором получали окрашенные осадки, ученик
- 13. Скачать презентацию






 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс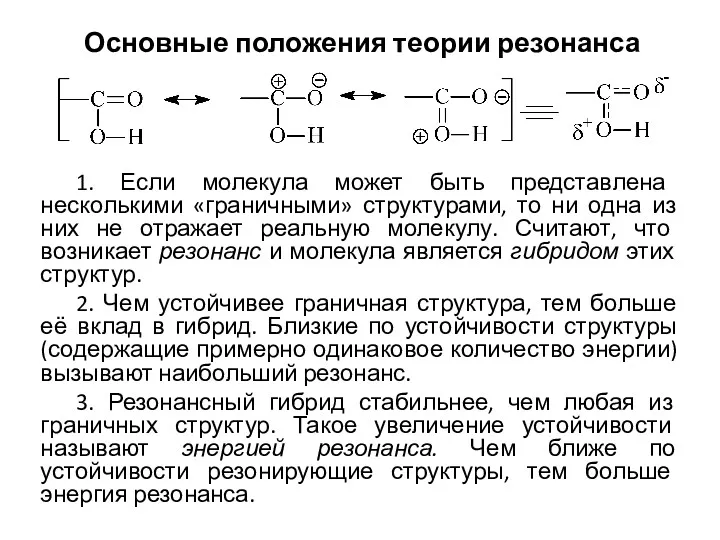 Основные положения теории резонанса
Основные положения теории резонанса Сера и ее соединения
Сера и ее соединения Массовая доля химического элемента
Массовая доля химического элемента Вяжущие вещества
Вяжущие вещества Химическая промышленность России
Химическая промышленность России Гідроліз солей
Гідроліз солей Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Химический элемент кремний
Химический элемент кремний Полимеры, бумага
Полимеры, бумага Количество вещества. Моль
Количество вещества. Моль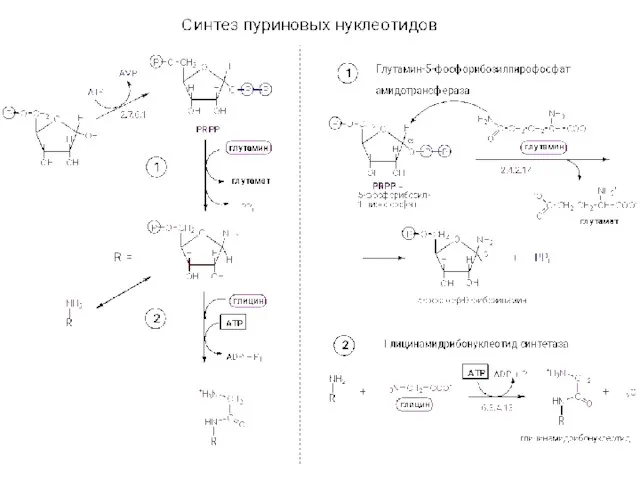 Синтез нуклеотидов
Синтез нуклеотидов Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Целлюлоза
Целлюлоза Алкины. Ацетилены
Алкины. Ацетилены Введение в химическую термодинамику
Введение в химическую термодинамику Biomass Feedstocks
Biomass Feedstocks Коллигативные свойства растворов
Коллигативные свойства растворов Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Лекция 7. Кислотно-основное равновесие в растворах
Лекция 7. Кислотно-основное равновесие в растворах Алканы. Гомологи
Алканы. Гомологи Контроль качества пищевых товаров
Контроль качества пищевых товаров Электрохимические процессы
Электрохимические процессы