Слайд 2

Задачи:
Познакомить с растворением, как с физико-химическим процессом.
Дать классификацию растворов по признаку
растворимости.
Сформировать понятия:
Раствор,
Растворитель
Растворенное вещество
Слайд 3

Большинство веществ в природе находится в виде растворов:
Газообразные Жидкие Твёрдые
воздух спиртовые
настойки сплавы ме
Слайд 4

…у тебя нет ни вкуса, ни запаха, тебя невозможно описать, тобою
наслаждаются, не ведая, что ты такое. Нельзя сказать, что необходима для жизни: ты сама жизнь.
Антуан де Сент – Экзюпери.
Планета людей.
Слайд 5

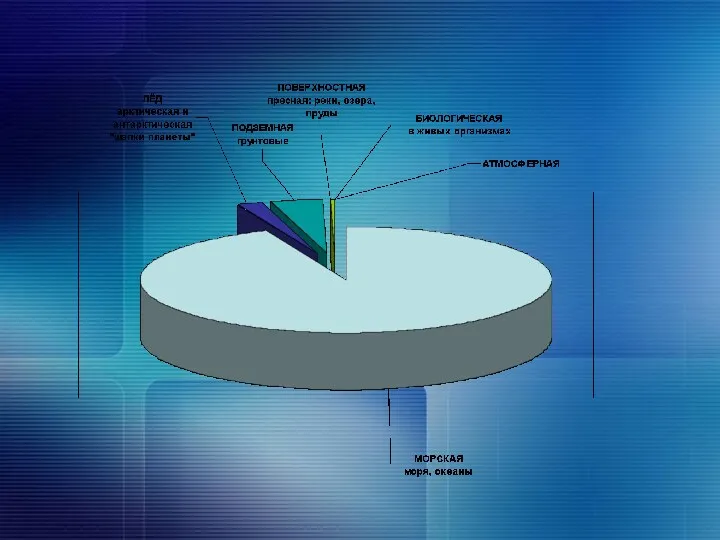
Самый распространённый растворитель – вода.
Растворение – это процесс разрушения растворяемого
вещества до структурных единиц (атомов, молекул, ионов) и их равномерное распределение по всему объёму растворителя.
Слайд 6
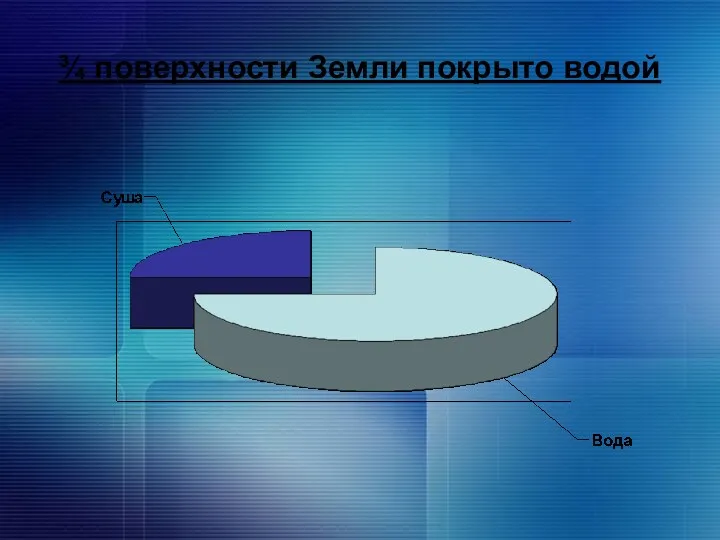
¾ поверхности Земли покрыто водой
Слайд 7
Слайд 8
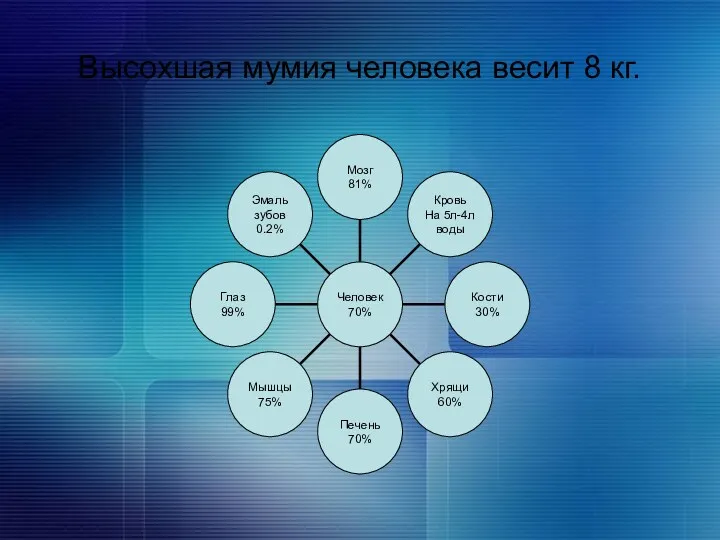
Высохшая мумия человека весит 8 кг.
Слайд 9

Раствор –
Это однородная система, состоящая из растворителя, растворённого вещества
и продуктов их взаимодействия.
Слайд 10

Процесс растворения
Физический :
диффузия, перемешивание
Химический:
выделение или поглощение тепла, изменение цвета
Слайд 11

Химическое взаимодействие с растворителем:
сольватация
Если растворитель вода –
гидратация
Слайд 12

Растворимость -
способность разрушаться под действием растворителя.
-Растворимые (более 1,0 г
на 100 г воды)
-Малорастворимые(0,1 г - 1,0 г на 100 г воды);
-Нерастворимые (менее 0,1 г на 100 г воды).
Слайд 13

Растворимость зависит от:
природы вещества
природы растворителя
температуры
давления (для газов)
Слайд 14

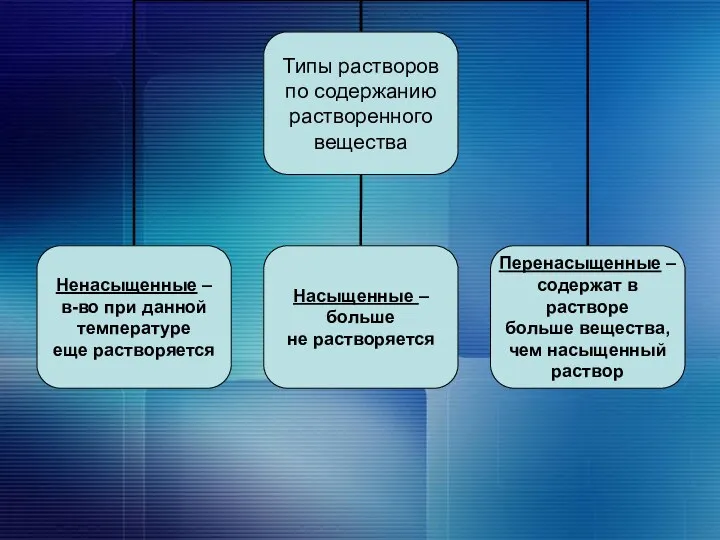
Коэффициент растворимости -
это число, показывающее, сколько граммов вещества может
раствориться в 100 г воды при данной температуре.
В зависимости от того, достигнут коэффициент растворимости или нет, растворы делят на:
насыщенные
ненасыщенные
перенасыщенные
Слайд 15
Слайд 16

Применение растворов
в промышленности
Слайд 17

Применение растворов в сельском хозяйстве
Слайд 18

Применение растворов
в быту и медицине
Слайд 19

Количественный состав растворов выражается с помощью концентраций:
ω = mр.в/mр – ра
* 100%
φ = Vр.в /Vр-ра * 100%
(омега)
(фи)
Массовая доля
Объёмная доля
Слайд 20

Решение задач
Какова массовая доля соли в растворе, приготовленном из 180
г воды и 20 г соли?
Слайд 21

Дано:
m( р.в) = 20 г
m(р-ля) = 180 г
ω(р.в) - ?
Решение:
1. Рассчитаем
m(р-ра)
m(р-ра) =m(р-ля) +m(р.в.)
m(р-ра) =180г +20г = 200г
2. Запишем формулу для расчета ω(р.в)
m(р.в.)
ω(р.в) = *100%
m(р-ра)
20г
ω(р.в) = *100% =10%
200г
Ответ: ω(р.в) = 10%
Слайд 22

Задача №2
Какую массу серной кислоты и воды необходимо взять для приготовления
350 г 20%-ного раствора кислоты?
Ответ : m( р.в) = 70 г
m(р-ля) = 280 г





















 Кинетика химических реакций. Химическое равновесие
Кинетика химических реакций. Химическое равновесие Химические процессы зоны гипергенеза
Химические процессы зоны гипергенеза Амінокислоти. Білки як біологічні полімери. Денатурація білка. Біологічна роль амінокислот та білків. 9 клас
Амінокислоти. Білки як біологічні полімери. Денатурація білка. Біологічна роль амінокислот та білків. 9 клас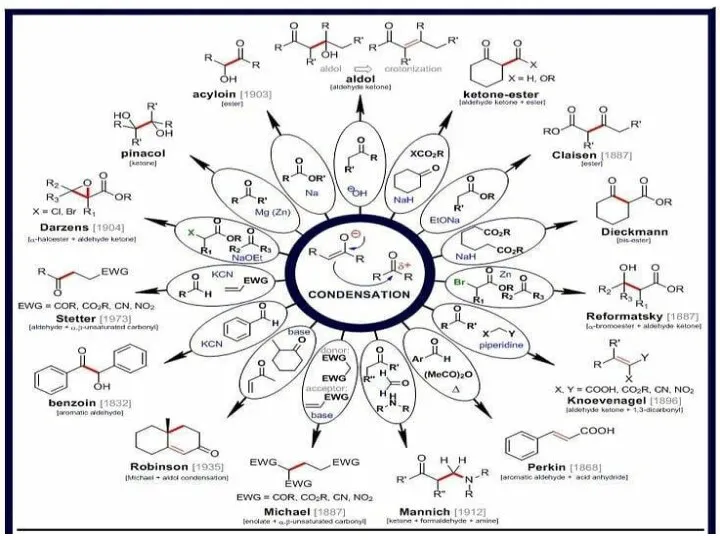 Альдольные реакции енолятов
Альдольные реакции енолятов Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Чистые вещества и смеси (продолжение)
Чистые вещества и смеси (продолжение) Амины. Анилин
Амины. Анилин Растворы электролитов
Растворы электролитов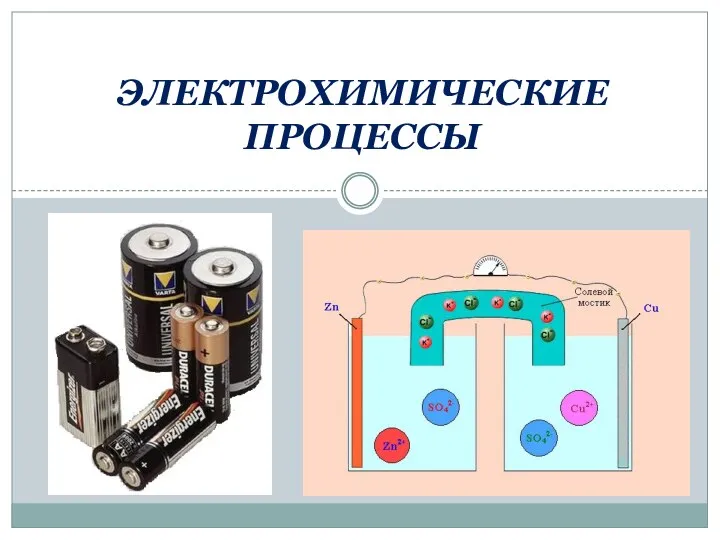 Электрохимические процессы
Электрохимические процессы Гідроліз солей
Гідроліз солей Понятие о единичных и симметрично-равных направлениях
Понятие о единичных и симметрично-равных направлениях Типичные окислители
Типичные окислители БАЗ-дың заманауи, ғылыми классификациясы. 3 Лекция
БАЗ-дың заманауи, ғылыми классификациясы. 3 Лекция Основания. Неорганические соединения
Основания. Неорганические соединения Химические волокна. Полиэфирные волокна. Лавсан
Химические волокна. Полиэфирные волокна. Лавсан Хром. Элемент под № 24
Хром. Элемент под № 24 Алкадиены. Циклоалканы. Лекция № 5
Алкадиены. Циклоалканы. Лекция № 5 Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Химическая связь
Химическая связь Мир камня. Чувашский национальный музей
Мир камня. Чувашский национальный музей Elements of group 2 (IIA)
Elements of group 2 (IIA) Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы
Причина отказа повреждений технологического оборудования и принятия мер по их устранению установки производства газовой серы Сформировать понятие о химическом составе пищи
Сформировать понятие о химическом составе пищи Электролитическая диссоциация
Электролитическая диссоциация Лекция 4. Классификация и механизмы органических реакций
Лекция 4. Классификация и механизмы органических реакций Строение вещества и агрегатные состояния вещества
Строение вещества и агрегатные состояния вещества Позднемеловая трубка взрыва щелочных базальтов Красноозерная
Позднемеловая трубка взрыва щелочных базальтов Красноозерная