Слайд 2
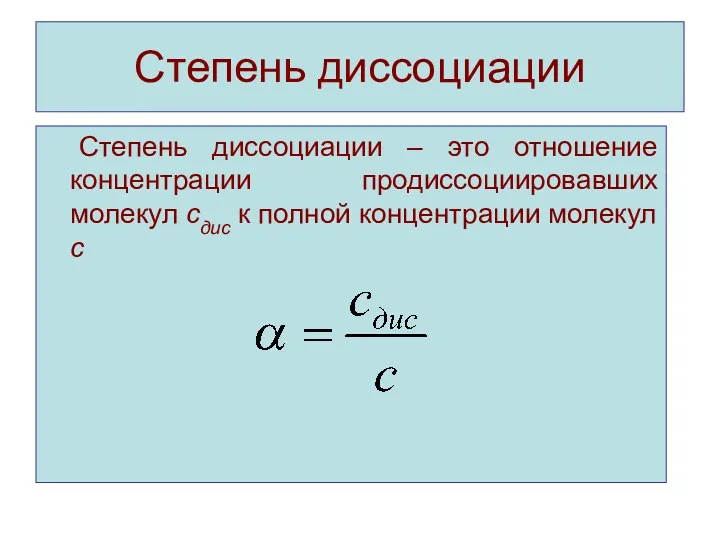
Степень диссоциации
Степень диссоциации – это отношение концентрации продиссоциировавших молекул сдис к
полной концентрации молекул с
Слайд 3

Сильные и слабые электролиты
Слайд 4

Диссоциация слабых электролитов
Слабые электролиты диссоциируют неполностью, то есть большая часть молекул
не распадается на ионы.
Наряду с диссоциацией идет и обратная реакция – взаимодействие противоположно заряженных ионов с образованием молекул:
HNO2 ⇄H+ + NO2-
азотистая катион нитрит-ион
кислота водорода
Слайд 5
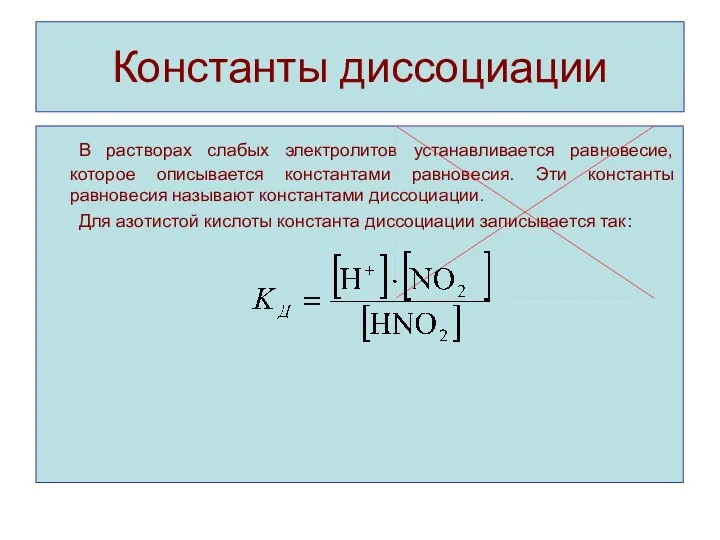
Константы диссоциации
В растворах слабых электролитов устанавливается равновесие, которое описывается константами равновесия.
Эти константы равновесия называют константами диссоциации.
Для азотистой кислоты константа диссоциации записывается так:
Слайд 6

Закон разведения Оствальда
Закон разведения Оствальда устанавливает связь между константой и степенью
диссоциации:
Слайд 7

Основные классы соединений с точки зрения
теории электролитической диссоциации
Кислоты – это электролиты,
которые при диссоциации образуют в качестве катионов только ионы водорода.
Сильные кислоты диссоциируют практически необратимо, в одну ступень:
HCl H++Cl-
Слабые – обратимо и по ступеням, число которых определяется их основностью. При этом каждая ступень характеризуется собственным значением константы диссоциации:
Слайд 8

Основания – это электролиты, которые при диссоциации образуют в качестве анионов
только гидроксид-ионы .
Сильные основания диссоциируют необратимо и полностью в одну ступень:
NaOH OH-+Na+
Слабые – обратимо и по ступеням, число которых равно кислотности основания, и каждой соответствует собственное значение константы диссоциации:
Слайд 9

Слайд 10

Соли – это электролиты, образующие при диссоциации катионы осно́вных остатков и
анионы кислотных остатков.
Ионов, общих для всех солей, не существует. Поэтому нет и общих для растворов всех солей свойств.
Практически все соли являются сильными электролитами и при растворении полностью диссоциируют:
Слайд 11

Реакции обмена в растворах электролитов
Реакции обмена – это реакции, в
ходе которых реагенты обмениваются своими составными частями без изменения степени окисления элементов.
Реакция ионного обмена необратима, если из ионов образуется:
1)малорастворимое вещество, которое выводится из зоны реакции в форме осадка;
2)летучее в условиях реакции вещество, которое удаляется из зоны реакции в виде газа или пара;
3)малодиссоциированное вещество (слабый электролит) или сложный ион.
Слайд 12

Примеры практически необратимых реакций:
Слайд 13

Если слабые электролиты или малорастворимые вещества имеются не только среди продуктов,
но и среди исходных веществ, то реакция является в той или иной мере обратимой. При этом равновесие смещено в направлении образования более слабых электролитов или менее растворимых веществ.
Примеры обратимых реакций, равновесие которых смещено вправо:
Слайд 14

Ионное произведение воды
Вода – это слабый амфотерный электролит:
H2O ⇄H++ OH-
При диссоциации
молекул воды образуются как катионы водорода Н+, так и гидроксид-ионы ОН-.
Чаще всего диссоциацию воды характеризуют ионным произведением воды:
КW = [H+]⋅[OH-]
При 22°С КW = 10-14 (моль/л)2.
В чистой воде концентрации ионов Н+ и ОН- равны между собой и могут быть рассчитаны так:
[H+] = [OH-] =
Слайд 15

Водородный показатель
Водородный показатель – это отрицательный десятичный логарифм концентрации катионов водорода
в растворе:
рН = - lg[H+]
Гидроксильный показатель – это отрицательный десятичный логарифм концентрации гидроксид-ионов в растворе:
рОН = - lg[ОH-]
pH + pOH = 14
Слайд 16
![Нейтральная, кислая и щелочная среда В нейтральной среде [H+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/598424/slide-15.jpg)
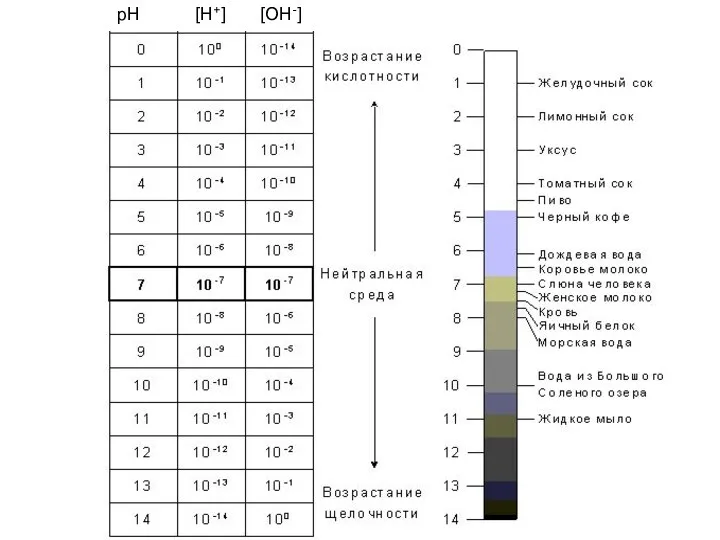
Нейтральная, кислая и щелочная среда
В нейтральной среде
[H+] = [OH-] = 10-7
моль/л
рН = 7
В кислой среде
[H+] > [OH-]
рН < 7
В щелочной среде
[H+] < [OH-]
рН > 7
Слайд 17














![Нейтральная, кислая и щелочная среда В нейтральной среде [H+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/598424/slide-15.jpg)

 Алкадиены. Непредельные углеводороды
Алкадиены. Непредельные углеводороды Классификация моторных масел
Классификация моторных масел Получение водорода. Проверка Н2 на чистоту. Практическая работа
Получение водорода. Проверка Н2 на чистоту. Практическая работа Симметрия в химии
Симметрия в химии Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях
Использование потенциостата-гальваностата Elins p-20x в электрохимических исследованиях Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9 Титан және оның қорытпалары. Титаннан жасалған құралдар
Титан және оның қорытпалары. Титаннан жасалған құралдар Коллигативные свойства растворов
Коллигативные свойства растворов Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Распространение пламени в газах
Распространение пламени в газах Молекулярно-кінетичні явища в дисперсних системах
Молекулярно-кінетичні явища в дисперсних системах Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие
Элементы химической термодинамики. 1 и 2 законы термодинамики. Химическое равновесие Роль хімії у житті суспільства
Роль хімії у житті суспільства Химическая связь
Химическая связь Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Кристаллы и минералы
Кристаллы и минералы Получение полимеров из низкомолекулярных соединений
Получение полимеров из низкомолекулярных соединений Неон. Физические свойства
Неон. Физические свойства XXI ғасыр көшбасшысы
XXI ғасыр көшбасшысы Электрохимические процессы. Лекция 7
Электрохимические процессы. Лекция 7 Закономерности управления каталитическими процессами
Закономерности управления каталитическими процессами Кислород и его применение
Кислород и его применение Материаловедение. Контрольная работа
Материаловедение. Контрольная работа Умные полимеры в биотехнологии и медицине
Умные полимеры в биотехнологии и медицине Аммиак. 9 класс
Аммиак. 9 класс Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Оксиды
Оксиды Основные сведения о строении атома
Основные сведения о строении атома