Содержание
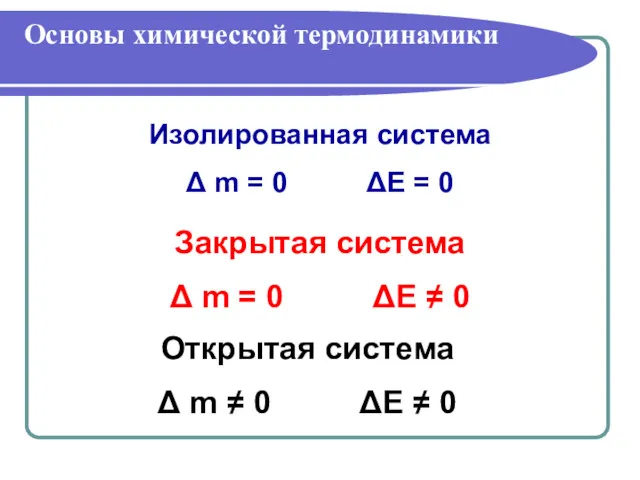
- 2. Основы химической термодинамики Изолированная система Δ m = 0 ΔЕ = 0 Закрытая система Δ m
- 3. Основы химической термодинамики Экстенсивные параметры: масса (m) объём (V) энергия (Е) энтропия (S) Интенсивные параметры: давление
- 4. Функциями состояния являются следующие величины: Температура (Т) Объем (V) Давление (P) Внутренняя энергия (U) Энтальпия (H)
- 5. Основы химической термодинамики Математическое выражение первого начала термодинамики Q = ΔU + W
- 6. При изохорном процессе V = const, тогда Δ V = 0, W = Р×∆V, то W
- 7. При изобарном процессе P = const Н = U + PV Основы химической термодинамики Qp =
- 8. Основы химической термодинамики I закон термодинамики для изобарных процессов ∆Нр = ∆U + P∆V
- 9. ЗАКОН ГЕССА Тепловой эффект реакции при постоянном объеме или давлении не зависит от пути процесса, а
- 10. Основы химической термодинамики Стандартные условия Т = 298 К Р = 1, 013×105 Н/м2
- 11. Первое следствие из закона Гесса: Основы химической термодинамики ΔH0 = Σn ΔH0298 обр. пр.р.- Σn ΔH0298
- 12. Второе следствие из закона Гесса Основы химической термодинамики ΔH0сгор =Σn ΔH0 298 сгор. исх. в-в. -
- 13. Первое начало термодинамики к живым организмам Основы химической термодинамики ΔU = 0, тогда Q = W
- 14. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ. S = f (Q) АНАЛИТИЧЕСКОЕ ВЫРАЖЕНИЕ 2-го НАЧАЛА ТЕРМОДИНАМИКИ
- 15. [S] = Дж/К, [ΔS] = Дж/моль×К
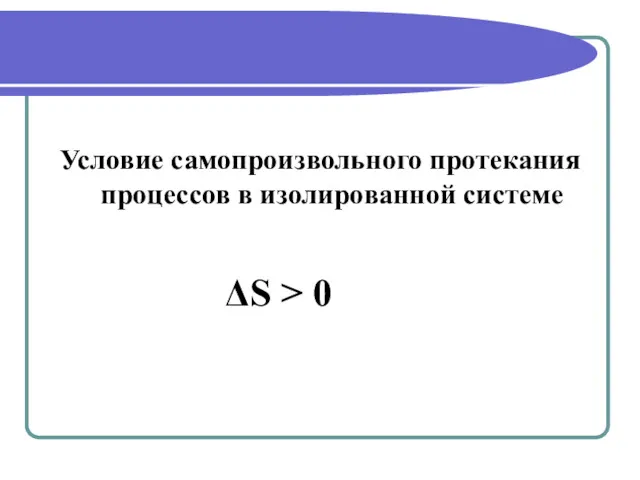
- 16. Условие самопроизвольного протекания процессов в изолированной системе ΔS > 0
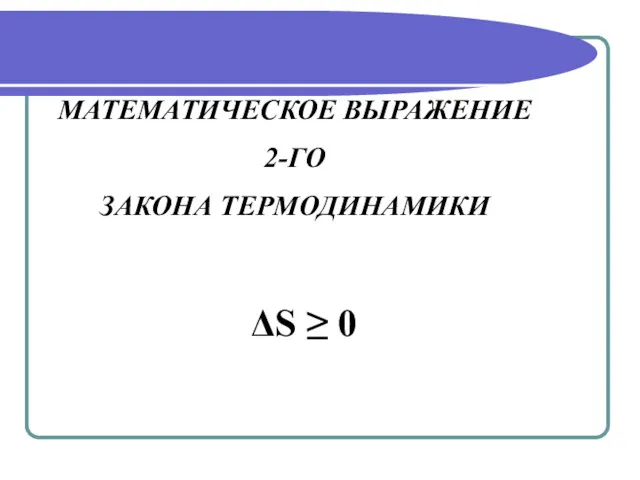
- 17. МАТЕМАТИЧЕСКОЕ ВЫРАЖЕНИЕ 2-ГО ЗАКОНА ТЕРМОДИНАМИКИ ΔS ≥ 0
- 18. РАСЧЁТ ЭНТРОПИИ РЕАКЦИИ ΔS0298= ∑n×S0прод. р-ции -∑n×S0 исх. в-в
- 19. Условие возможности протекания реакции в прямом направлении без затраты энергии ΔG ΔG > 0, то реакция
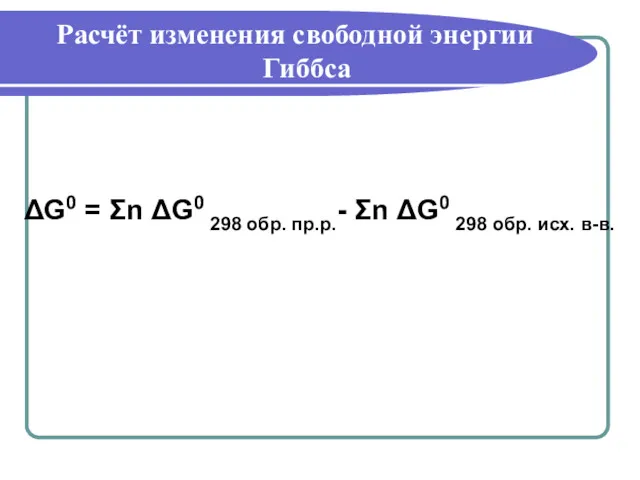
- 20. Расчёт изменения свободной энергии Гиббса ΔG0 = Σn ΔG0 298 обр. пр.р.- Σn ΔG0 298 обр.
- 21. ΔG0 = ΔH0 – TΔS0 УРАВНЕНИЕ ГИББСА
- 22. АНАЛИЗ УРАВНЕНИЯ ГИББСА 1) ΔG0 0 3)ΔG0 0, ΔS0 > 0 - при высоких температурах, |ТΔS
- 23. Химические реакции, протекающие в организме при ΔG называют экзергоническими Реакции, в которых ΔG>0 и над системой
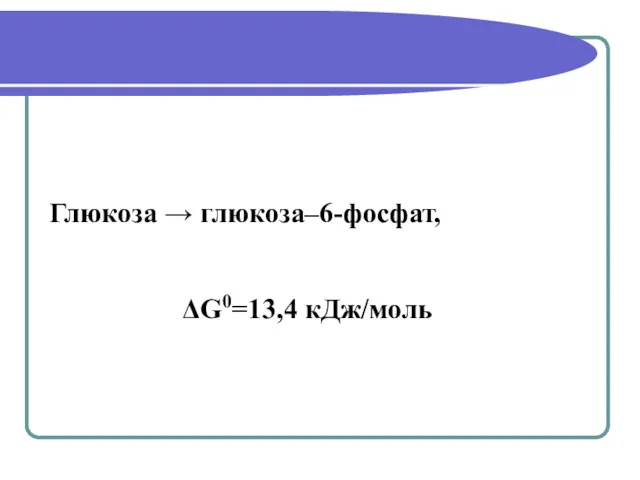
- 24. Глюкоза → глюкоза–6-фосфат, ΔG0=13,4 кДж/моль
- 25. АТФ + 4Н2О →АДФ +Н3РО4, ΔG0= - 30,6кДж/моль ΔG0 = 13,4 - 30,6 = -17,2 кДж/моль
- 26. ХИМИЧЕСКОЕ РАВНОВЕСИЕ c, d, a, b – стехиометрические коэффициенты реакции [C], [D], [A], [B] – равновесные
- 27. Выражение константы равновесия через парциальное давление
- 28. Признаки истинного равновесия 1) Равенство скоростей прямой и обратной реакции; 2) Сохранением своего состояния во времени
- 29. Уравнение изотермы химической реакции при стандартных условиях Kc - константа равновесия реакции
- 30. УРАВНЕНИЕ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ
- 31. АНАЛИЗ УРАВНЕНИЯ ИЗОТЕРМЫ ХИМИЧЕСКОЙ РЕАКЦИИ -если Kc > Пс, то ΔG сторону прямой реакции, ; если
- 33. Скачать презентацию












![[S] = Дж/К, [ΔS] = Дж/моль×К](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121551/slide-14.jpg)












 Альдегіди. Будова молекул
Альдегіди. Будова молекул Техника безопасности в кабинете химии
Техника безопасности в кабинете химии Химические свойства основных неорганических соединений в свете ЭД и ОВР
Химические свойства основных неорганических соединений в свете ЭД и ОВР Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Алюминий и его соединения
Алюминий и его соединения Решение заданий по теме Химические свойства основных классов неорганических веществ
Решение заданий по теме Химические свойства основных классов неорганических веществ Смеси, растворы. Тест
Смеси, растворы. Тест Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Азотная кислота и ее соли
Азотная кислота и ее соли Коррозия металлов
Коррозия металлов Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Органічні розчинники
Органічні розчинники Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Окислительно-восстановительные реакции. Урок в 11 классе
Окислительно-восстановительные реакции. Урок в 11 классе Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Антибиотики пенициллинового ряда
Антибиотики пенициллинового ряда Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ)
Жидкокристаллические композиты ЖКК. Керамические композиционные материалы (ККМ). Углерод-углеродные композиционные (УУКМ) История открытия химических веществ
История открытия химических веществ Защитно-декоративные покрытия
Защитно-декоративные покрытия Титриметрический метод анализа
Титриметрический метод анализа Основные классы неорганических соединений
Основные классы неорганических соединений Спроби класифікації хімічних елементів
Спроби класифікації хімічних елементів Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Понятие биогенности химических элементов
Понятие биогенности химических элементов Биохимическая трансформация веществ (2)
Биохимическая трансформация веществ (2) Происхождение названий минералов
Происхождение названий минералов