Содержание
- 2. План 4.1. Классификация органических реакций 4.2. Классификация реагентов 4.3.Реакции радикального заме-щения (SR) 4.4 Реакции электрофильного при-соединения
- 3. 4.1 Классификация органических реакций по направлению Реакции замещения S Реакции присоединения A Реакции элиминирования E Молекулярные
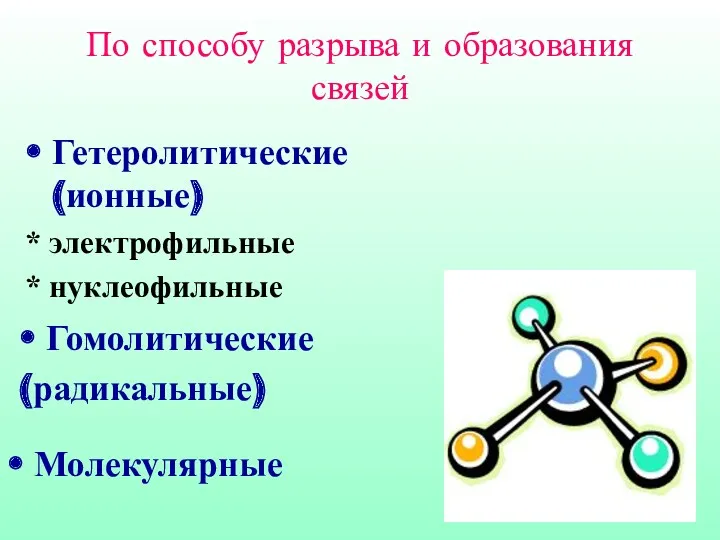
- 4. Гетеролитические (ионные) * электрофильные * нуклеофильные Гомолитические (радикальные) Молекулярные По способу разрыва и образования связей
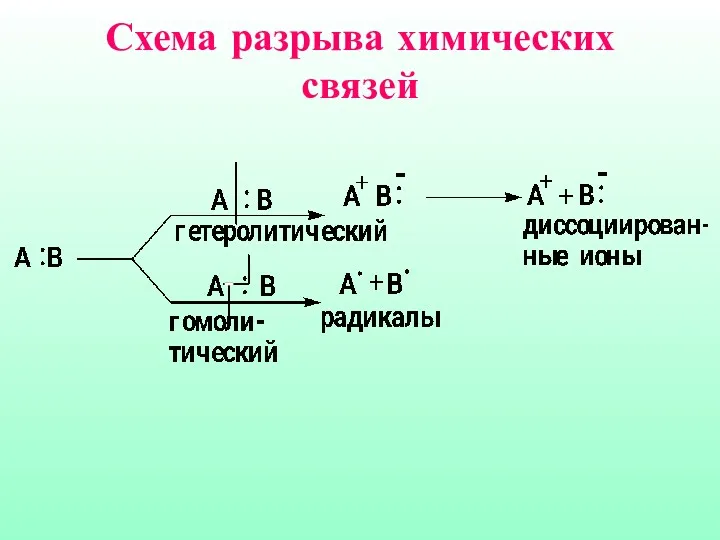
- 5. Схема разрыва химических связей
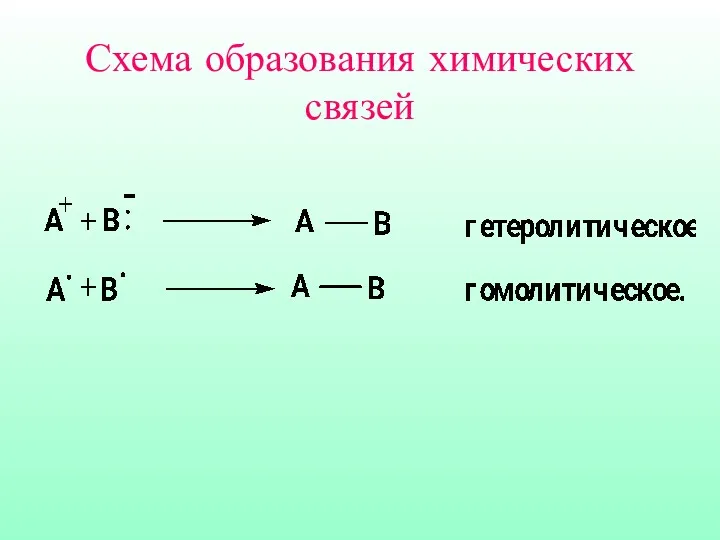
- 6. Схема образования химических связей
- 7. Гетеролитические реакции называют ионными, поскольку они сопровождаются образованием органических ионов, протекают в органических растворителях Гомолитические реакции
- 8. Гетеролитические реакции в зависимости от электронной природы атакующей частицы делят на нуклеофильные (символ N) и электрофильные
- 9. Субстрат – молекула, которая поставляет атом углерода для образования новой связи Тип реакции (нуклеофильный или электрофильный)
- 10. Реагент с неподеленной электронной парой, взаимодействующий с субстратом, имеющим недостаток электронов, называют «нуклеофильным» (любящим, ищущим ядро),
- 11. Реагент с электронным де-фицитом, взаимодействующий с субстратом, обладающим из-бытком электронов, называют «электрофильным», а реакцию электрофильной
- 12. Нуклеофильные и электрофильные реакции всегда связаны между собой Реакции, сопровождающиеся одновременным (согласованным) разрывом и образованием связей,
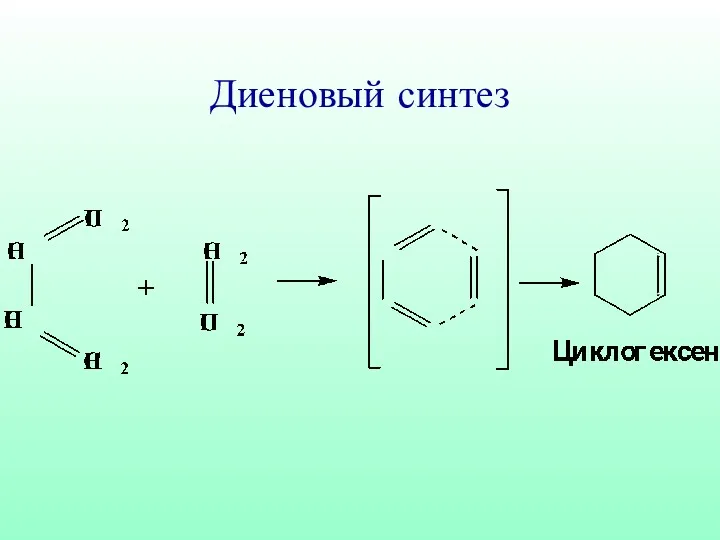
- 13. Диеновый синтез
- 14. 4.2. Классификация реагентов К нуклеофильным реагентам относят молекулы, содержащие одну или более неподеленных пар электронов; ионы,
- 15. Нуклеофильные реагенты нейтральные молекулы, имеющие неподеленные пары электронов: анионы: OH— ; CN—; NH2—; RCOO—; RS—; Cl—;
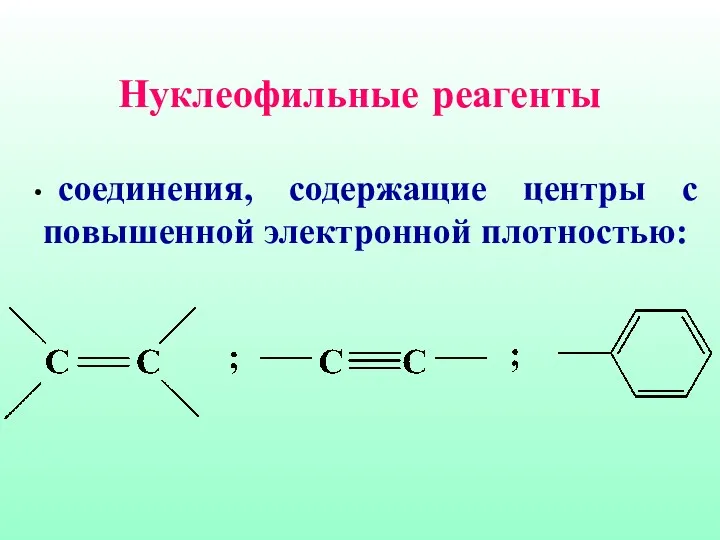
- 16. Нуклеофильные реагенты соединения, содержащие центры с повышенной электронной плотностью:
- 17. Электрофильные реагенты нейтральные молекулы, имеющие вакантную орбиталь: SO3, кислоты Льюиса (AlCl3, SnCl4, FeBr3, BF3) катионы: протон
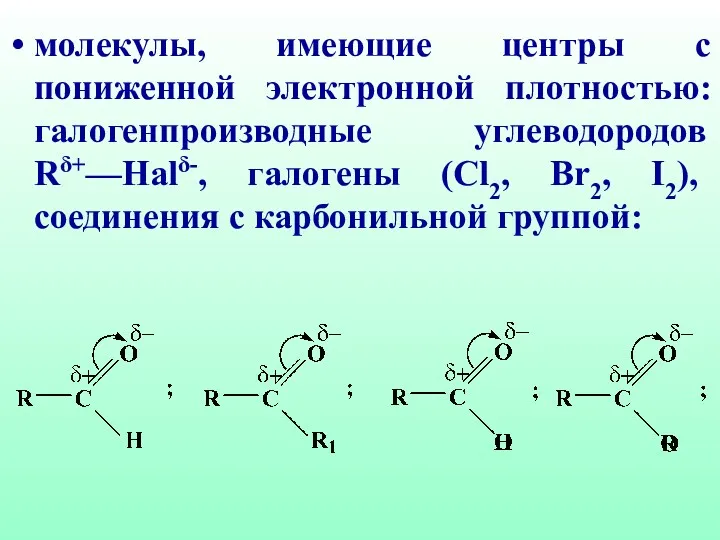
- 18. молекулы, имеющие центры с пониженной электронной плотностью: галогенпроизводные углеводородов Rδ+—Halδ-, галогены (Cl2, Br2, I2), соединения с
- 19. В органической химии реакции, как правило протекают в несколько стадий, т.е. с образованием промежуточных, короткоживущих частиц
- 20. Карбкатионы – положительно заряженные частицы, атом углерода, несущий положительный заряд находится в sр2 – гибридизации. Атом
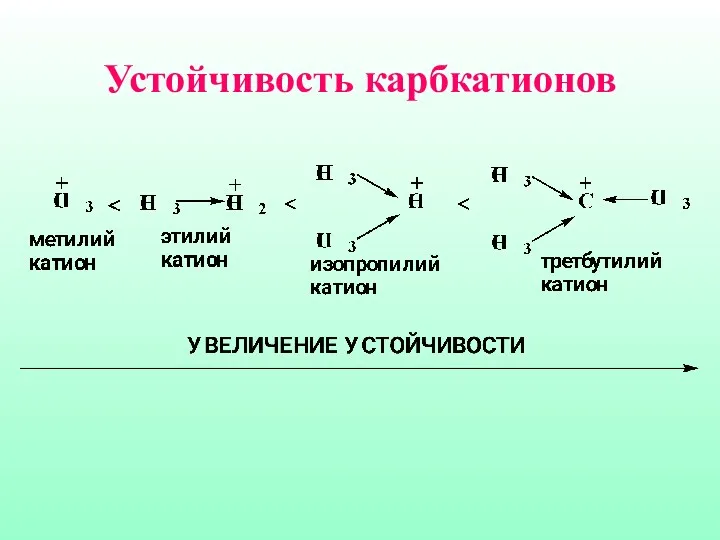
- 21. Важной характеристикой карбкатионов является их устойчивость, которая определяется степенью делокализации положительного заряда
- 22. Устойчивость карбкатионов падает в ряду:
- 23. Устойчивость карбкатионов
- 24. Карбанионы – отрицательно заряженные частицы, заряд которых обусловлен наличием в их структуре атома С с неподеленной
- 25. Устойчивость карбанионов зависит от степени делокализации отрицательного заряда на атоме углерода. Чем она выше, тем выше
- 26. циклопентадиенил анион
- 27. Свободные радикалы – любая электронейтральная активная частица, содержащая одноэлектронную орбиталь. К свободным радикалам могут быть отнесены
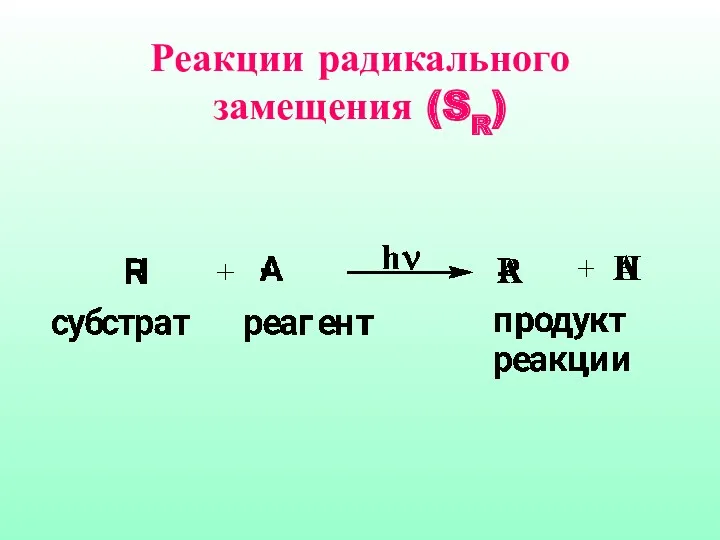
- 28. 4.3. Реакции радикального замещения (SR) Реакции SR характерны для соединений алифатического и алициклического рядов. Как правило,
- 29. На стадии инициирования образуются свободные радикалы, дающие начало цепному процессу Свободные радикалы могут возникать за счет
- 30. Реакции радикального замещения (SR)
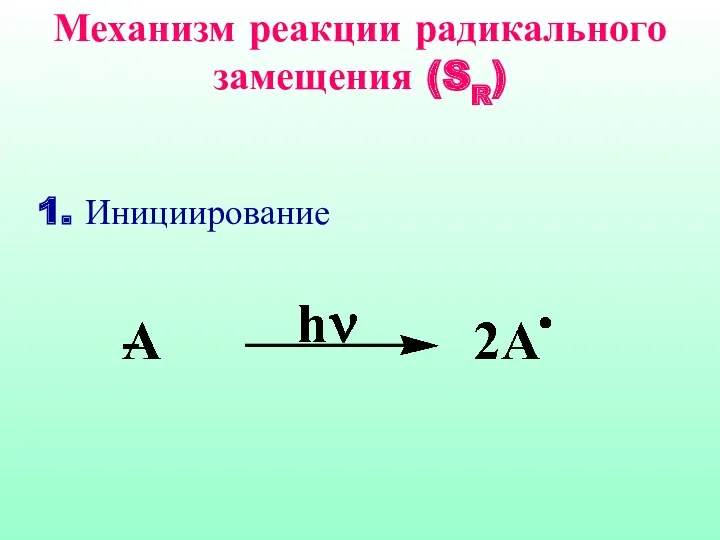
- 31. Механизм реакции радикального замещения (SR) Механизм реакции радикального замещения (SR) 1. Инициирование
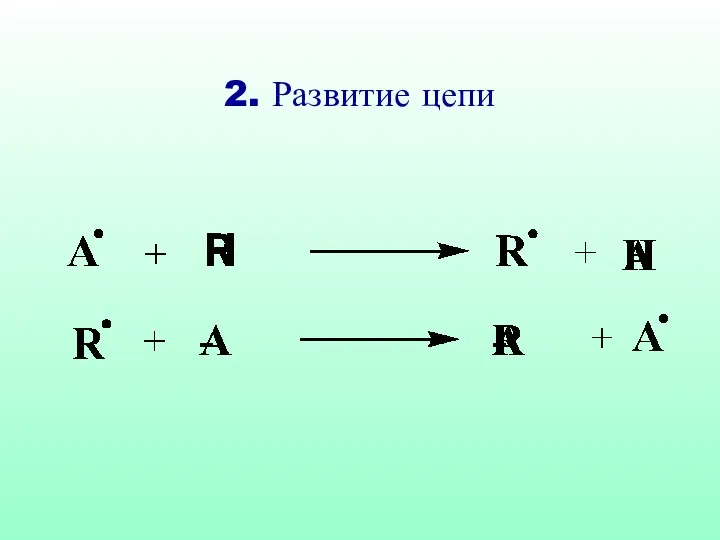
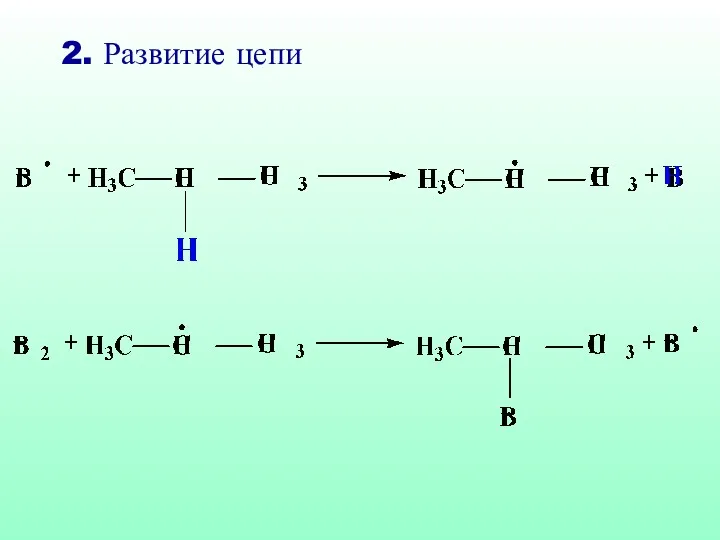
- 32. 2. Развитие цепи
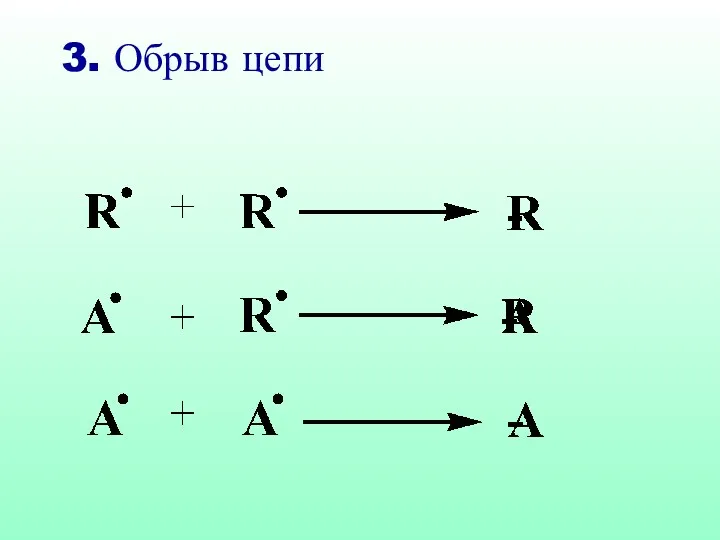
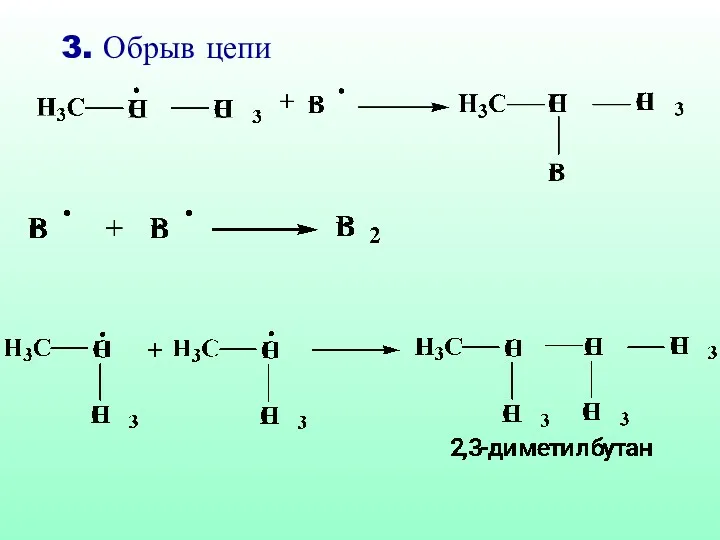
- 33. 3. Обрыв цепи
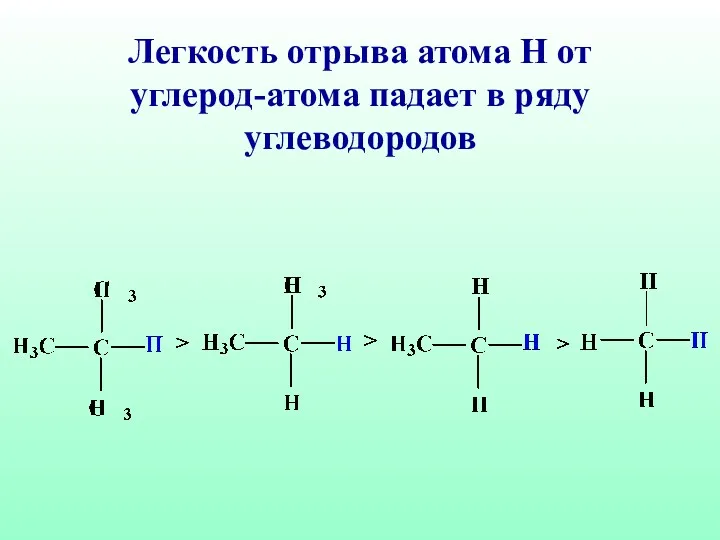
- 34. Легкость отрыва атома Н от углерод-атома падает в ряду углеводородов
- 35. Радикалы брома (Вr˙) обладают высокой избирательностью: если в молекуле имеются вторичный, а тем более третичный атом
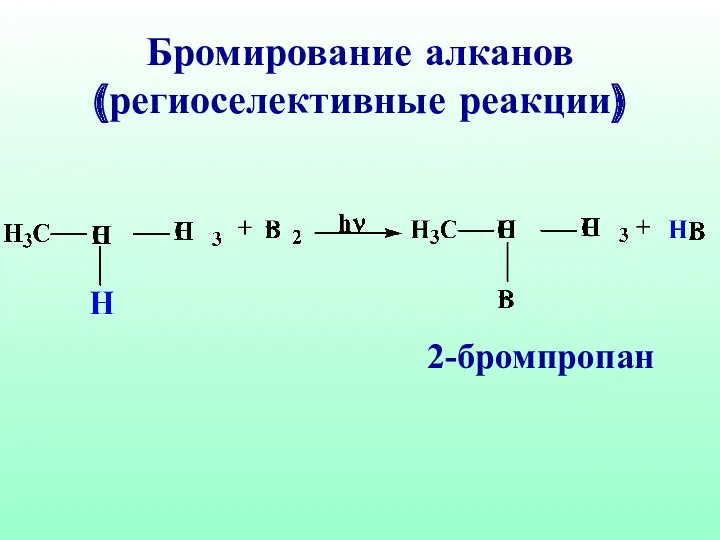
- 36. Бромирование алканов (региоселективные реакции) 2-бромпропан
- 37. 1. Инициирование Механизм реакции бромирования алканов
- 38. 2. Развитие цепи
- 39. 3. Обрыв цепи
- 40. 4.4. Реакции электрофильного присоединения Электрофильное присоединение (АЕ) характерно для ненасыщенных систем, содержащих двойные или тройные связи.
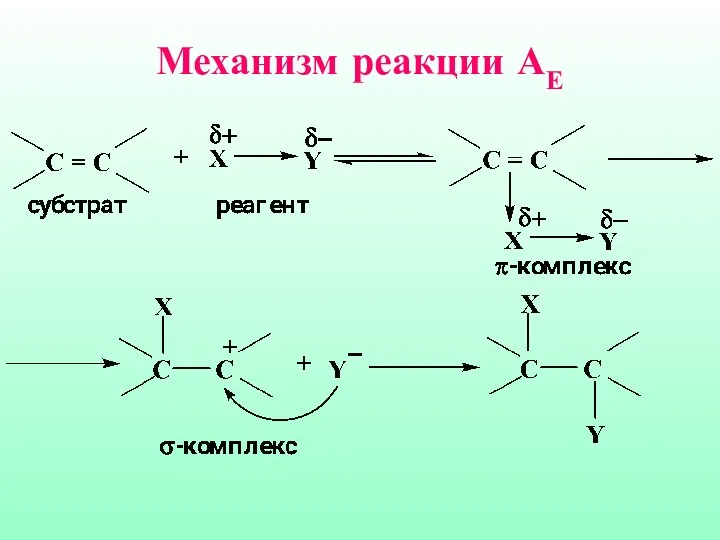
- 41. Механизм реакции АЕ
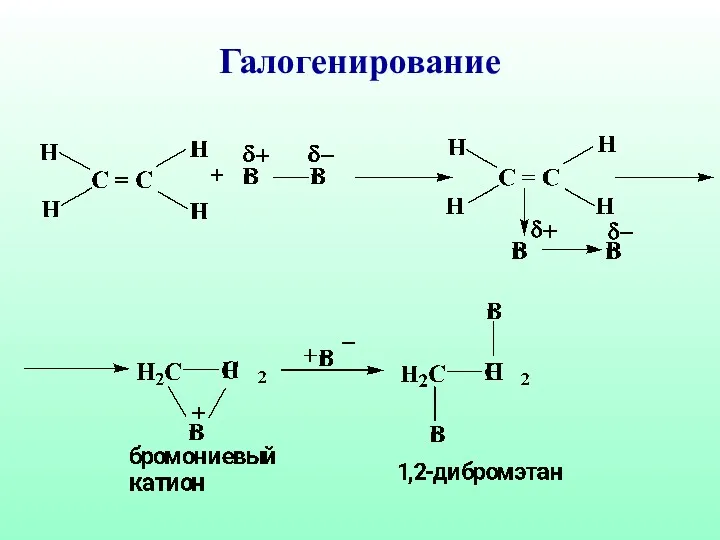
- 42. Галогенирование
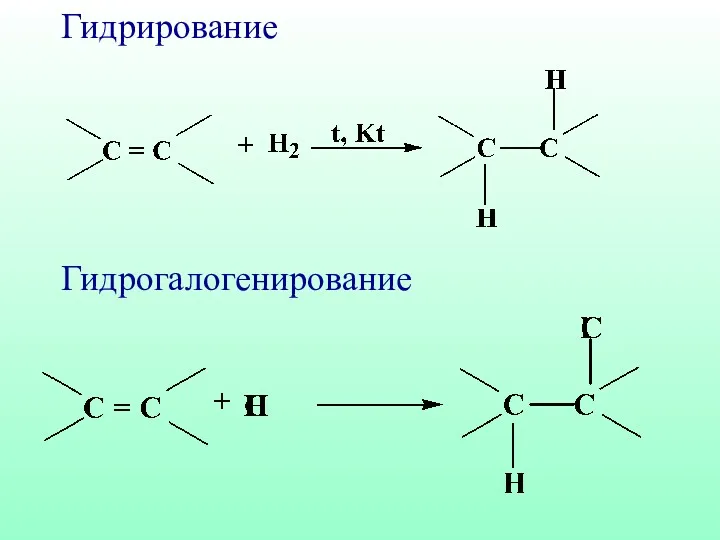
- 43. Гидрирование Гидрогалогенирование
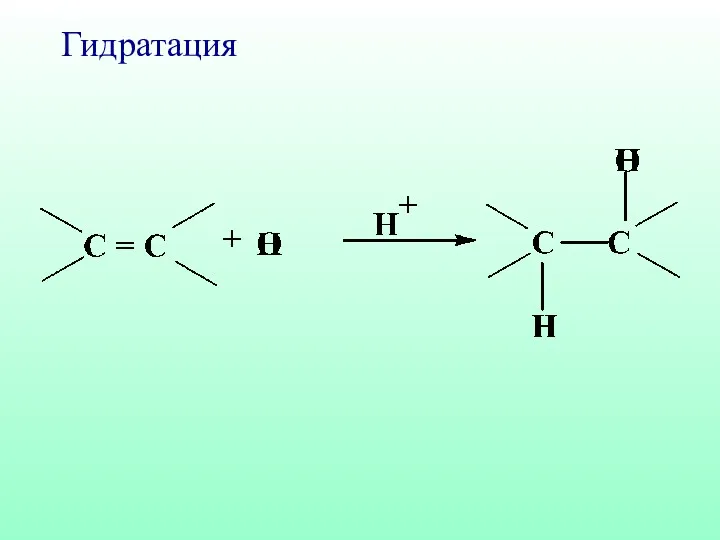
- 44. Гидратация
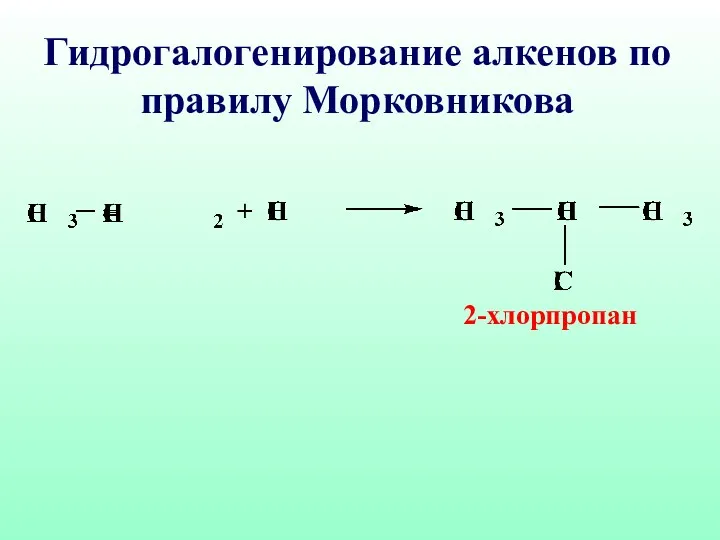
- 45. Правило Марковникова: при взаимодействии реагентов типа НХ с несимметричными алкенами, водород присоединяется к наиболее гидрогенизированному атому
- 46. 2-хлорпропан Гидрогалогенирование алкенов по правилу Морковникова
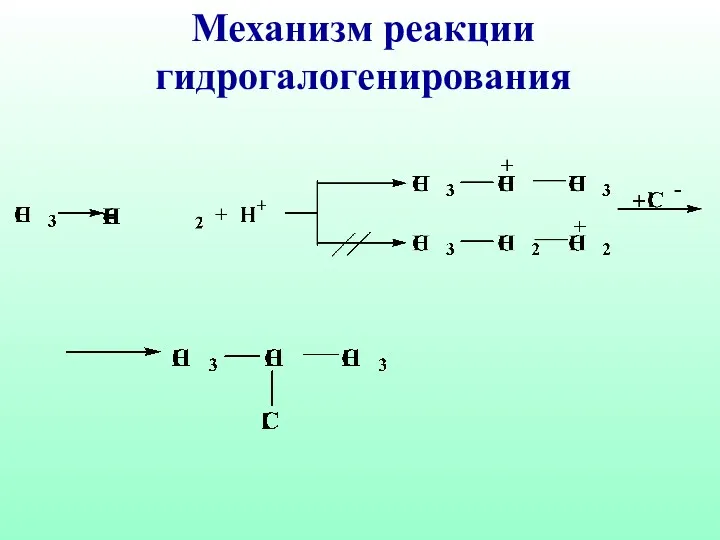
- 47. Механизм реакции гидрогалогенирования
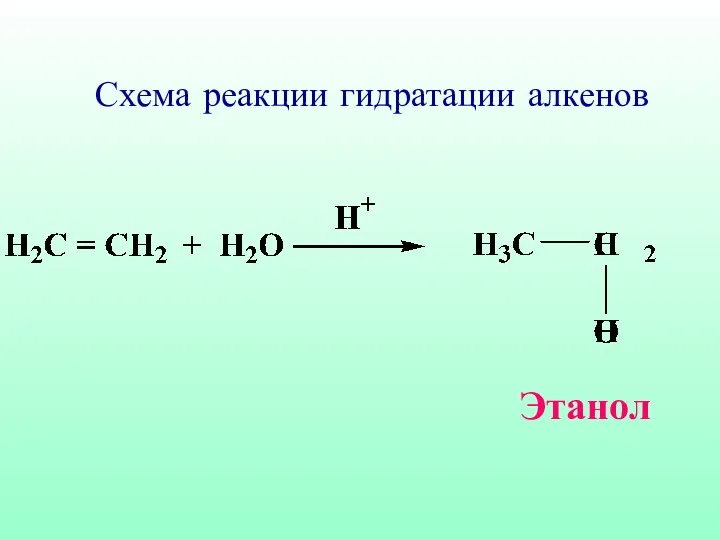
- 48. Схема реакции гидратации алкенов Этанол
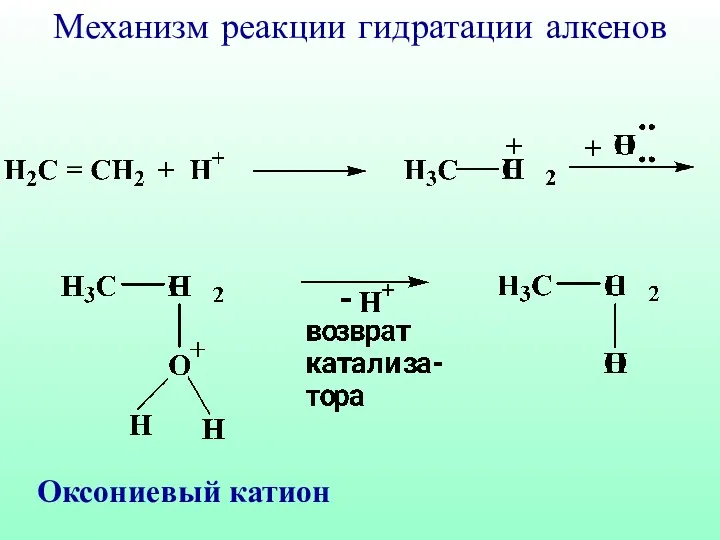
- 49. Оксониевый катион Механизм реакции гидратации алкенов
- 50. Классическое правило Марковникова идеально применимо только к самим алкенам, в случае их производных необходимо учитывать и
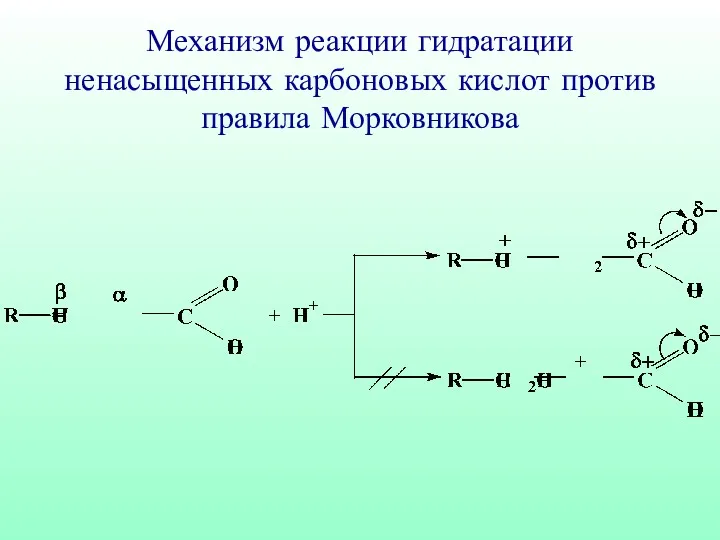
- 51. Механизм реакции гидратации ненасыщенных карбоновых кислот против правила Морковникова
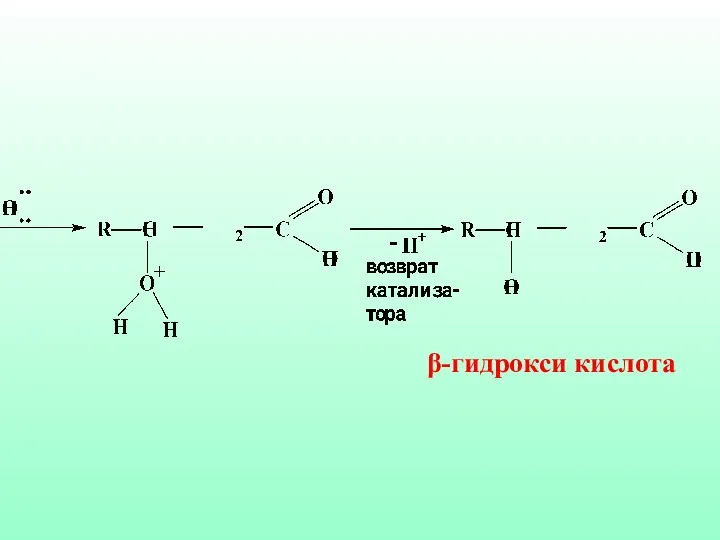
- 52. β-гидрокси кислота
- 53. Такого типа гидратация in vivo является частью процесса β-окисления ненасыщенных жирных кислот в организме
- 54. Сопряженные системы (алкадиены) термодинамически наиболее устойчивы, поэтому часто встречаются в природе. Реакции АЕ с такими диенами
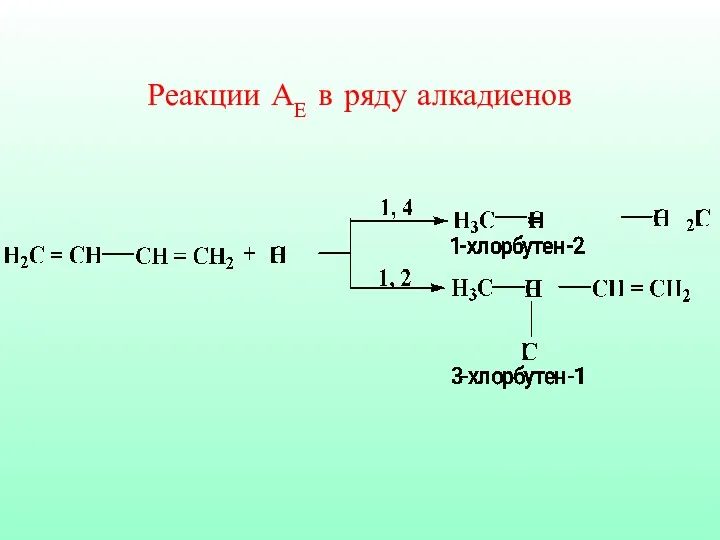
- 55. Реакции АЕ в ряду алкадиенов
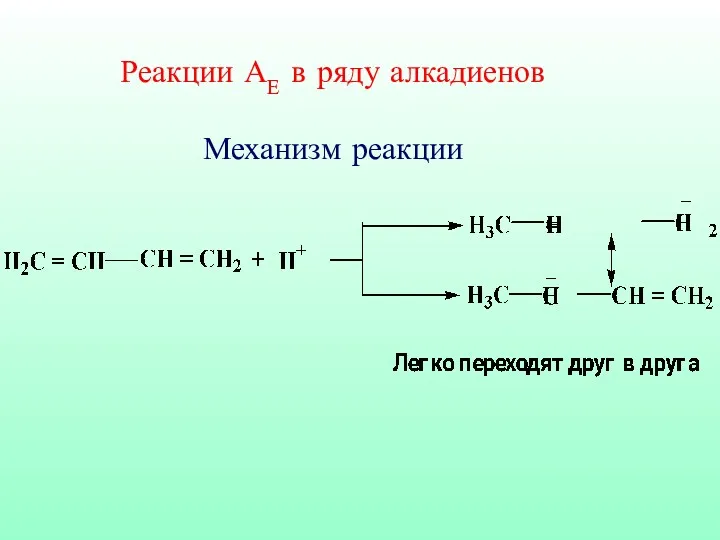
- 56. Реакции АЕ в ряду алкадиенов Механизм реакции
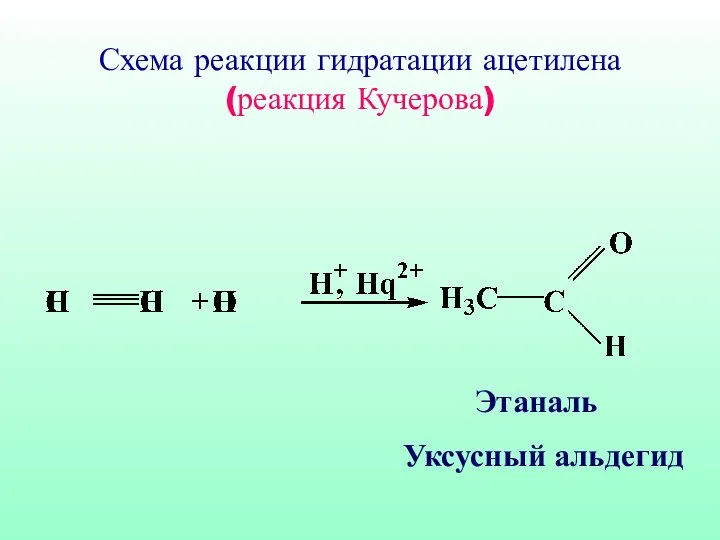
- 57. Схема реакции гидратации ацетилена (реакция Кучерова) Этаналь Уксусный альдегид
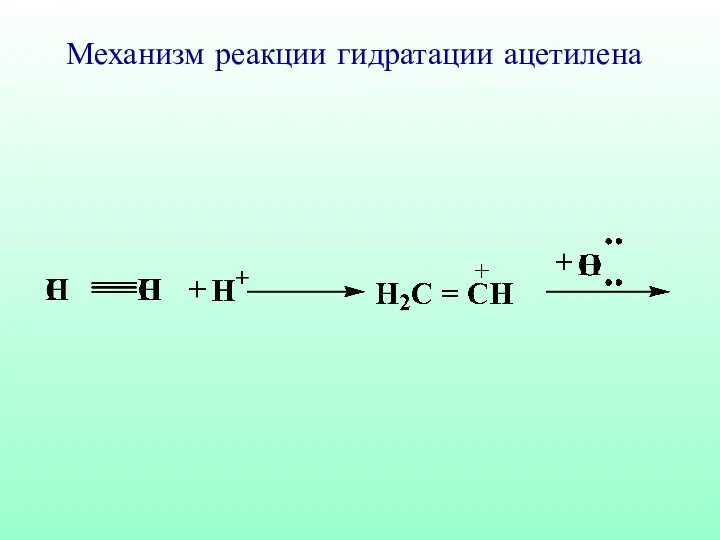
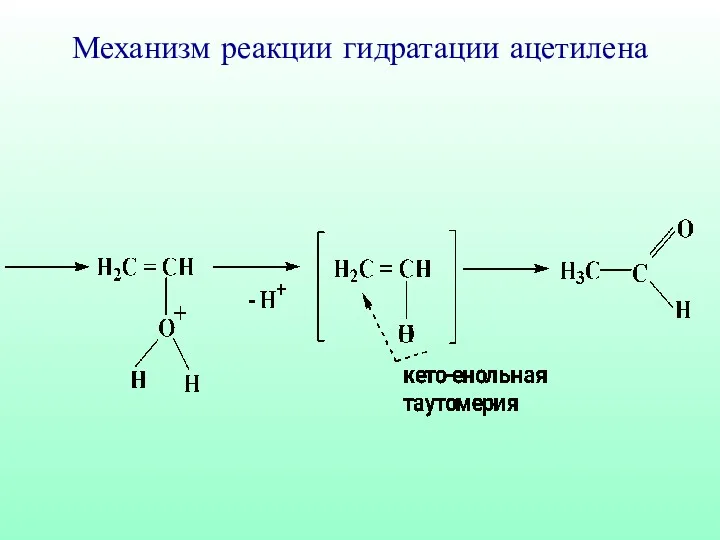
- 58. Механизм реакции гидратации ацетилена
- 59. Механизм реакции гидратации ацетилена
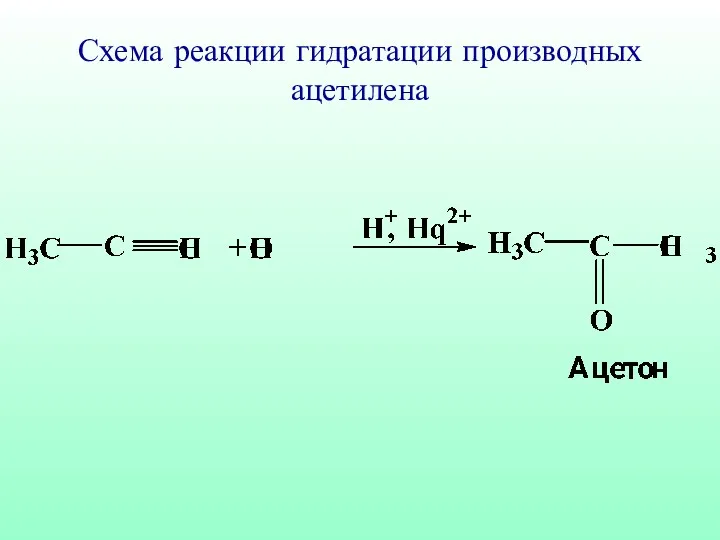
- 60. Схема реакции гидратации производных ацетилена
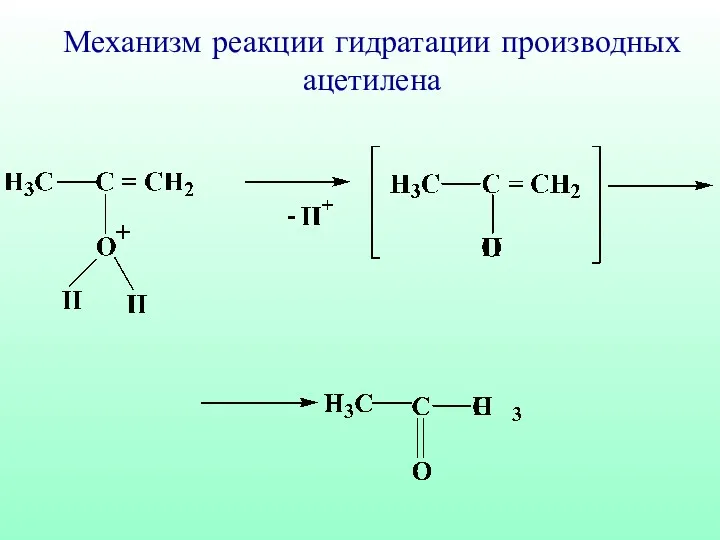
- 61. Механизм реакции гидратации производных ацетилена
- 62. Механизм реакции гидратации производных ацетилена
- 64. Скачать презентацию





























 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)