Содержание
- 2. Дисперсная система Дисперсная фаза- это раздробленная фаза, она состоит из частиц нерастворимого тонкоизмельченного вещества, распределенных по
- 3. Признаки объектов коллоидной химии
- 4. Для коллоидных систем характерно интенсивное броуновское движение частиц дисперсной фазы. По степени взаимодействия между молекулами дисперсной
- 5. Эффект Тиндаля рассеяние света при прохождении светового пучка через оптически неоднородную среду. Обычно наблюдается в виде
- 6. Зависимость удельной поверхности от размера частиц II – высокодисперсные, коллоидные (наносистемы) 10-9 III – среднедисперсные (микрогетерогенные)
- 7. Виды дисперсных систем
- 8. Дисперсионная среда: ГАЗ Дисперсная фаза: ГАЗ Всегда гомогенная смесь (воздух, природный газ) Дисперсная фаза: Жидкость Туман,
- 9. Дисперсионная среда: Жидкость Дисперсная фаза: ГАЗ Шипучие напитки, пены Дисперсная фаза: Жидкость Эмульсии. Жидкие среды организма
- 10. Дисперсионная среда: Твёрдое вещество Дисперсная фаза: ГАЗ Снежный наст с пузырьками воздуха в нём, почва, кирпич
- 11. Строение коллоидных мицелл
- 14. {m[ AgI ] n I- (n-x) K+}x-x K+
- 15. Получение дисперсных систем измельчение крупных образцов вещества до частиц дисперсных размеров; химический состав и агрегатное состояние
- 16. основаны на ассоциации молекул в агрегаты из истинных растворов; используют для получения высокодисперсных систем; не требуют
- 17. Стадии конденсации 2. Рост зародышей. 3. Формирование слоя стабилизатора (ДЭС).
- 18. Физические конденсационные методы
- 19. Химические конденсационные методы
- 21. 3. Реакции окисления Образование золя серы. 2H2Sр-р + O2 = 2S ↓+ 2H2O Строение мицеллы:
- 22. 4. Реакции гидролиза Получение золя гидроксида железа. FeCl3 + 3H2O = Fe(OH)3 ↓ + 3HCl Cтроение
- 23. Метод пептизации
- 24. Низкомолекулярные примеси (чужеродные электролиты) разрушают коллоидные системы. Диализ – отделение золей от низкомолекулярных примесей с помощью
- 25. Особенности коллоидных растворов Опалесценция (светорассеяние) наблюдается когда λ > d. Чем короче длина волны падающего света,
- 26. 2. Способность к электрофорезу - явление перемещения частиц ДФ относительно неподвижной ДС по действием внешнего электрического
- 27. Устойчивость и коагуляция дисперсных систем
- 28. Коагуляция золей электролитами Все электролиты при определенной концентрации могут вызвать коагуляцию золя. Правило знака заряда: коагуляцию
- 29. Порог коагуляции (γ, Спор) – наименьшая концентрация электролита, достаточная для того, чтобы вызвать коагуляцию золя Коагулирующая
- 30. Седиментация Седиментацией называют процесс оседания частиц дисперсной фазы в жидкой или газообразной среде под действием силы
- 31. КОЛЛОИДНЫЕ СИСТЕМЫ В ОРГАНИЗМЕ Можно смело сказать, что весь человек – это ходячий коллоид, а все
- 32. Кости – это коллаген, насыщенный кальцием и фосфором.
- 33. Кровь – это дисперсная система, в которой ферментные элементы эритроциты, тромбоциты, лейкоциты являются фазой, а плазма
- 34. Кожа, мышцы, ногти, волосы, кровеносные сосуды, легкие, весь желудочно-кишечный тракт и многое другое, без чего немыслима
- 36. Скачать презентацию












![{m[ AgI ] n I- (n-x) K+}x-x K+](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/361958/slide-13.jpg)




















 Анализ проб воды
Анализ проб воды Carbohydrates and their metabolism. Digestion of carbohydrates
Carbohydrates and their metabolism. Digestion of carbohydrates Химические свойства и получение алканов
Химические свойства и получение алканов Олово и свинец
Олово и свинец Күкірт қышқылы
Күкірт қышқылы Показатели химической обстановки при авариях на химически опасных объектах
Показатели химической обстановки при авариях на химически опасных объектах Жуғыш заттар және жуғыш әсері. 2 Лекция
Жуғыш заттар және жуғыш әсері. 2 Лекция Кристаллы и минералы
Кристаллы и минералы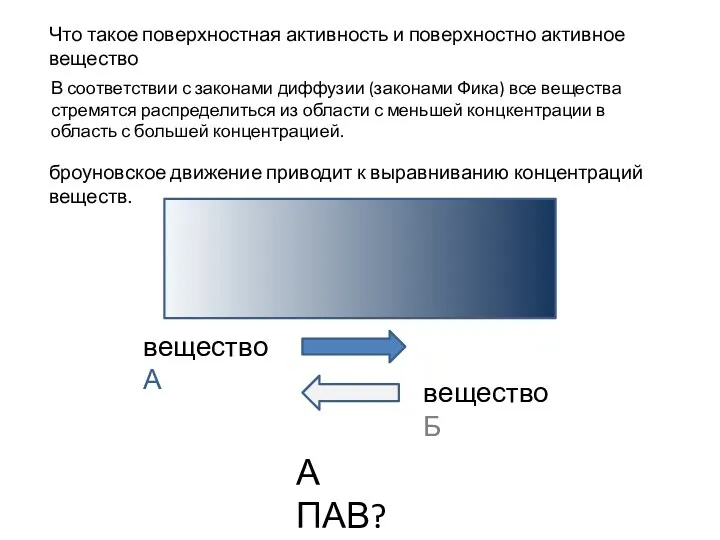 Поверхностная активность и поверхностно активное вещество
Поверхностная активность и поверхностно активное вещество Строение и свойства циклоалканов
Строение и свойства циклоалканов Химические реакции или химические явления
Химические реакции или химические явления Растворы ВМС
Растворы ВМС Констукционные и функциональные волокнистые композиты. Стекловолокно
Констукционные и функциональные волокнистые композиты. Стекловолокно Основные способы получения металлов
Основные способы получения металлов Расчет распределения пор по размерам из изотерм адсорбции
Расчет распределения пор по размерам из изотерм адсорбции Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас
Обчислення об'ємних відношень газів за хімічними рівняннями. Хімія. 9 клас Установка гидрокрекинга
Установка гидрокрекинга Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Арилалкиламины, гидроксифенилалкиламины и их производные
Арилалкиламины, гидроксифенилалкиламины и их производные Азотсодержащие органические соединения. Лекция 8
Азотсодержащие органические соединения. Лекция 8 Приёмы обращения с лабораторным оборудованием и основы техники безопасности
Приёмы обращения с лабораторным оборудованием и основы техники безопасности Особенности лантаноидов и актиноидов
Особенности лантаноидов и актиноидов Циклические углеводороды
Циклические углеводороды Полимеры
Полимеры Кристаллические решетки
Кристаллические решетки Алкадиены: строение, номенклатура, гомологи, изомерия
Алкадиены: строение, номенклатура, гомологи, изомерия Соли, их классификация и свойства
Соли, их классификация и свойства Молярная масса вещества
Молярная масса вещества