Содержание
- 2. Историческая справка Первоначально название «ароматические углеводороды» получили вещества, обладающие приятным запахом - например, фенилэтиловый спирт и
- 3. Физические свойства бензола При обычных условиях-бесцветная жидкость с характерным запахом, не смешивается с водой, является хорошим
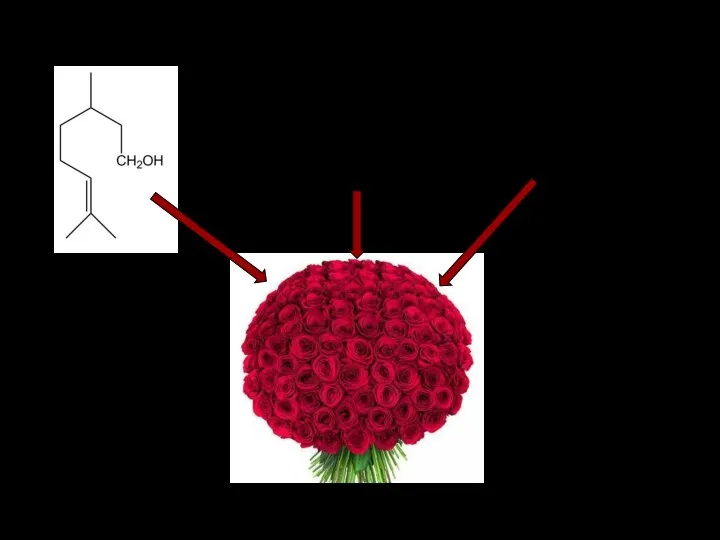
- 4. Фенилэтиловый спирт Гераниол Цитронеллол
- 5. Органические соединения, в состав которых входят одно или несколько бензольных колец, называются ароматическими углеводородами. Для гомологов
- 6. Бензол, электронное строение
- 7. Электронное строение молекулы бензола Общая формула моноциклических аренов СnH2n-6 (где n ≥ 6) показывает, что они
- 8. Бензол как бы состоит из 2-х альтернативных структур циклогексатриена-1,3,5. ⭤ Столь непредельное соединение не обесцвечивает бромную
- 9. s 2p sp2 Схема образования sp2-гибридных орбиталей атома углерода
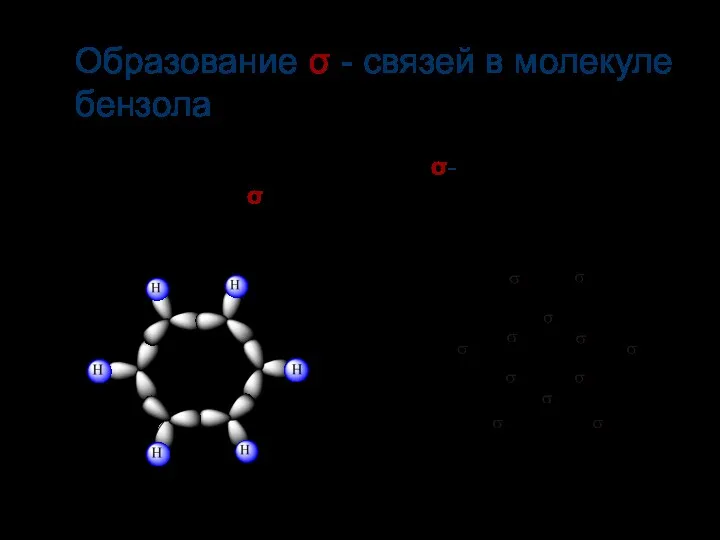
- 10. Физическими методами установлено, что все атомы углерода и водорода в молекуле бензола лежат в одной плоскости
- 11. Каждый атом «С» образует три σ-связи (2 С-С и 1 С-Н σ-связи) Образование σ - связей
- 12. Образование π- связей в молекуле бензолa π Четвёртый негибридизированный р-электрон каждого атома «С» расположен перпендикулярно плоскости
- 13. Атомы углерода в бензоле находятся в sp2-гибридизации; Угол расположения 3-х гибридных орбиталей равен 120° и они
- 16. «HIC TUTA PERENNAT» переводится с латинского языка, как «здесь в безопасности пребывает». Римская богиня мудрости Миневра
- 17. Ароматичность. Критерии ароматичности
- 18. Критерий ароматичности – правила Хюккеля 1931 год Ароматические - плоские циклические сопряженные системы, содержащие 4n+2 делокализованных
- 19. Сравнение стабильности – теплота гидрирования
- 20. Сравнение стабильности – теплота гидрирования Циклооктатетраен не ароматичен!
- 21. Сравнение стабильности – теплота гидрирования Q=+96 кДж/моль Циклооктатетраен не ароматичен!
- 22. Сравнение стабильности – теплота гидрирования Q=+96 кДж/моль Q=+410 кДж/моль Циклооктатетраен не ароматичен!
- 23. Сравнение стабильности – теплота гидрирования Q=+96 кДж/моль Q=+410 кДж/моль Примерно в 4 раза больше. Циклооктатетраен не
- 24. Сравнение стабильности – теплота гидрирования непредельных циклогексанов
- 25. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 26. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 27. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 28. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 29. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 30. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 31. Q=+120 кДж/моль Q=+232 кДж/моль Q=+(340-360) кДж/моль Q=+208 кДж/моль
- 32. Ароматичность – это совокупность нескольких факторов: Квантово-химический критерий- подчинение правилу Хюккеля и высокая энергия стабилизации 2)
- 33. Химические свойства бензола
- 34. Химические свойства бензола Ароматическая связь определяет свойства бензола 6 π-электронная система является более устойчивой, чем обычные
- 35. Хлорирование Гексахлорциклогексан (гексахлоран - инсектицид) Гидрирование Сильный пищевой и дыхательный яд (10-12 г – смертельная доза
- 36. Реакция сульфирования Сульфобензол; бензолсульфокислота II. Реакции замещения Реакция нитрования (нитруют смесью конц. кислот) Нитробензол
- 37. Реакция Зинина Водород в момент выделения: [H], а не H2 Из анилина далее азокрасители (рассмотрим позднее).
- 38. Теории кислот и оснований Аррениуса Н+ ОН-
- 39. NH3 + H+ = NH4OH Теории кислот и оснований Аррениуса Н+ ОН-
- 40. NH3 + H+ = NH4OH Бренстеда-Лоури Кислота: Н+ Основание – донор электронной пары Теории кислот и
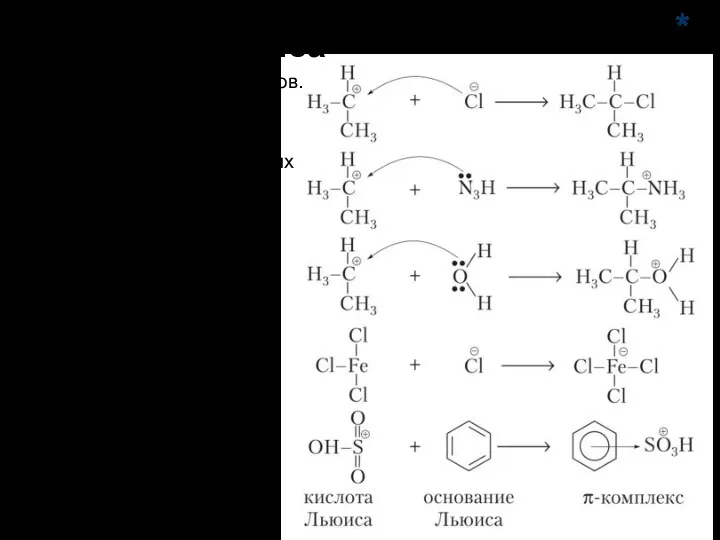
- 41. Кислоты Льюиса -акцепторы пары электронов. Для реакций SE в ароматических соединениях необходимы в качестве катализатора. Чаще
- 42. II. Реакции замещения Реакция галогенирования
- 43. Механизм реакции электрофильного замещения SE в ароматических соединениях
- 44. Механизм реакции электрофильного замещения SE в ароматических соединениях
- 45. Механизм реакции электрофильного замещения SE в ароматических соединениях δ− δ+
- 46. Реакции алкилирования (реакции Фриделя-Крафтса) 1. с галогеналканами 2. с алкенами 3. со спиртами II. Реакции замещения
- 47. Реакции алкилирования (реакции Фриделя-Крафтса) Изопропилбензол (кумол) II. Реакции замещения Но! Происходит изомеризация:
- 48. Реакции алкилирования (реакции Фриделя-Крафтса) II. Реакции замещения Но! Происходит изомеризация: Изопропилбензол (кумол)
- 49. Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции замещения За счёт чего происходит изомеризация *
- 50. Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции замещения За счёт чего происходит изомеризация *
- 51. Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции замещения За счёт чего происходит изомеризация Более стабильный катион *
- 52. Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции замещения За счёт чего происходит изомеризация *
- 53. Зачем нужен кумол *
- 54. Как избежать изомеризации – реакция с ацилгалогенидами (хлорангидридами карбоновых кислот) Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции
- 55. Как избежать изомеризации – реакция с ацилгалогенидами (хлорангидридами карбоновых кислот) Реакции алкилирования (реакции Фриделя-Крафтса). II. Реакции
- 56. II. Реакция радикального замещения (α-галогенирование - реакция Львова)
- 57. II. Реакция радикального замещения (α-галогенирование - реакция Львова)
- 58. Реакции электрофильного замещения с производными бензола Ориентационные эффекты заместителей
- 59. Номенклатура производных бензола 1,2-диметилбензол; орто-диметилбензол (о-диметилбензол)
- 60. Номенклатура производных бензола 1,2-диметилбензол; орто-диметилбензол (о-диметилбензол) 1,3-диметилбензол; мета-диметилбензол (м-диметилбензол)
- 61. Номенклатура производных бензола 1,2-диметилбензол; орто-диметилбензол (о-диметилбензол) 1,4-диметилбензол; пара-диметилбензол (п-диметилбензол) 1,3-диметилбензол; мета-диметилбензол (м-диметилбензол)
- 62. Наиболее характерными реакциями для ароматических углеводородов являются реакции электрофильного замещения SE. Химические свойства бензола
- 63. Наиболее характерными реакциями для ароматических углеводородов являются реакции электрофильного замещения SE. Химические свойства бензола Протекание реакции
- 64. Наиболее характерными реакциями для ароматических углеводородов являются реакции электрофильного замещения SE. Химические свойства бензола Протекание реакции
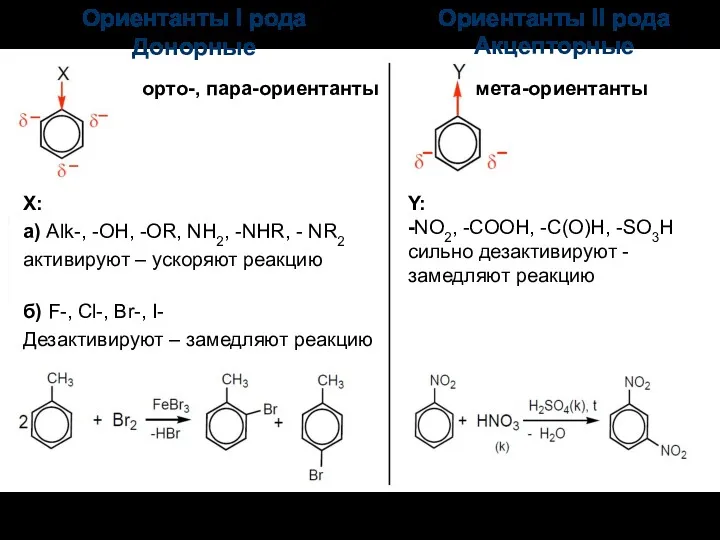
- 65. Ориентанты I рода Донорные Ориентанты II рода Акцепторные орто-, пара-ориентанты мета-ориентанты X: а) Alk-, -OH, -OR,
- 66. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом:
- 67. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом:
- 68. Задание: расположите соединения в порядке увеличения активности в реакции электрофильного замещения с бромом: Нитробензол—хлорбензол—этилбензол—фенол
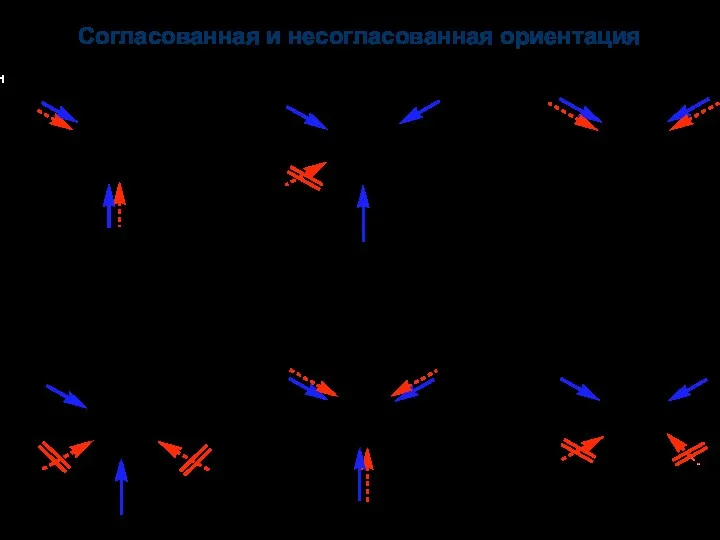
- 69. Согласованная и несогласованная ориентация 1 OH NO2 согл. согл. несогл. несогл. согл. несогл. OH NO2 OH
- 70. Кто куда
- 71. Кто куда
- 72. Кто куда
- 73. Кто куда
- 74. Реакции замещения с производными бензола Теория цветности, получение азокрасителей *
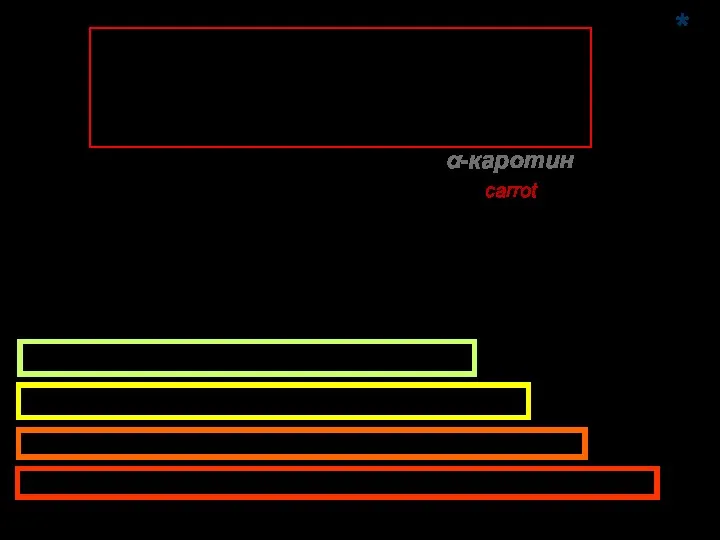
- 75. α-каротин (франц. сarrot – морковь) бесцветный бесцветный желто-зеленый желтый оранжевый красно-оранжевый *
- 76. жёлтый беcцветный *
- 77. Хромофоры (греч. хромо – цвет, феро – несу) сильные слабые Ауксохромы (греч. ауксо – увеличивать) -OH,
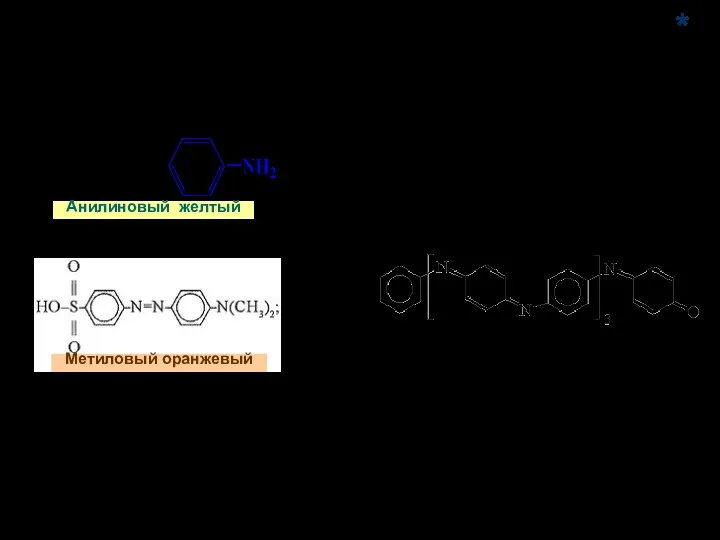
- 78. Реакция азосочетания Диазокомпонент Азокомпонент Метиловый оранжевый *
- 79. Реакции алкилирования (реакции Фриделя-Крафтса) с производными бензола. Азосочетание - азокрасители Метилоранж, Basic Red 76 Direct Brown
- 80. Анилиновый желтый 1863 г. Анилиновый черный Метиловый оранжевый *
- 81. Реакции окисления бензола и алкилбензолов
- 82. III. Реакции окисления Горение (бензол горит коптящим пламенем) 2С6Н6 + 15О2 → 12СО2 + 6Н2О Неполное
- 83. Окисление гомологов бензола Бензойная кислота
- 84. Окисление гомологов бензола Если у соседнего с кольцом атома углерода есть атом(ы) водорода – идёт окисление
- 85. Окисление бензола O2 , V2O5, 450 C C O O OH + HOOC COOH малеиновая кислота
- 86. Озонирование 3O3 O3 O3 O 3 O O O O O O O O O H2O
- 87. Получение бензола
- 88. Получение бензола В промышленности: 1) переработка нефти и угля 2) дегидрирование циклогексана 3) дегидроциклизация (ароматизация) гексана
- 89. В лаборатории 4) Тримеризация ацетилена (реакция Бертло-Зелинского) Сакт,600 С 3 НС ≡ СН → Сплавление солей
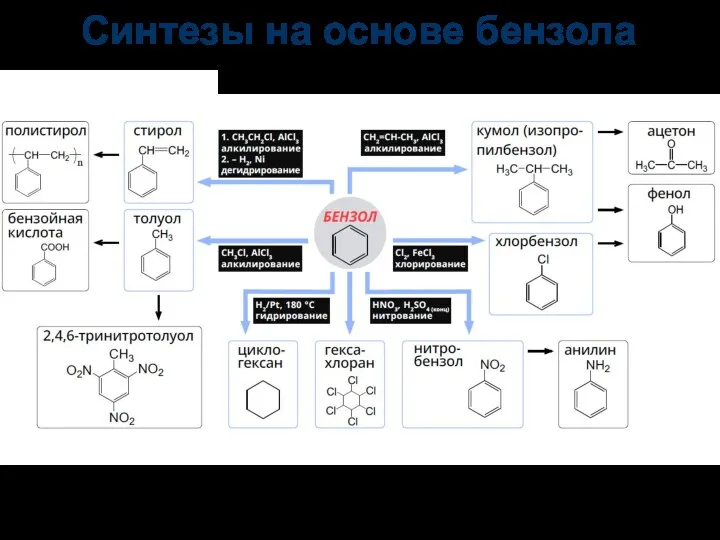
- 90. Синтезы на основе бензола
- 91. бензойная кислота бензол толуол фенол анилин кумол стирол Тривиалочки ☺
- 93. Какой объём бензола (ρ=0,9 г/мл) потребуется для получения 30,75 г нитробензола, если массовая доля выхода продукта
- 95. Скачать презентацию



























![Реакция Зинина Водород в момент выделения: [H], а не H2](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/183929/slide-36.jpg)















































 Теория сплавов
Теория сплавов Биосенсорные системы
Биосенсорные системы Соли. Классификация
Соли. Классификация Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Химическая взрывчатка
Химическая взрывчатка Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Тест по неорганической химии
Тест по неорганической химии Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Белки. Содержание белков в различных тканях
Белки. Содержание белков в различных тканях Водород. Химические свойства
Водород. Химические свойства Хлор
Хлор Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Объемная доля газа в смеси. (Урок 16. 7 класс)
Объемная доля газа в смеси. (Урок 16. 7 класс) Современные тенденции развития химии
Современные тенденции развития химии Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Незвичайна вода
Незвичайна вода Химия. Викторина
Химия. Викторина Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Соли аммония
Соли аммония Азотная кислота
Азотная кислота Керамические материалы
Керамические материалы Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Задачи
Задачи