Содержание
- 2. Открытию Периодического закона предшествовало накопление знаний о веществах и их свойствах. По мере открытия новых химических
- 4. БЕРЦЕЛИУС Йёнс Якоб (1779 г. - 1848 г.) ввёл современные обозначения химических элементов и формулы химических
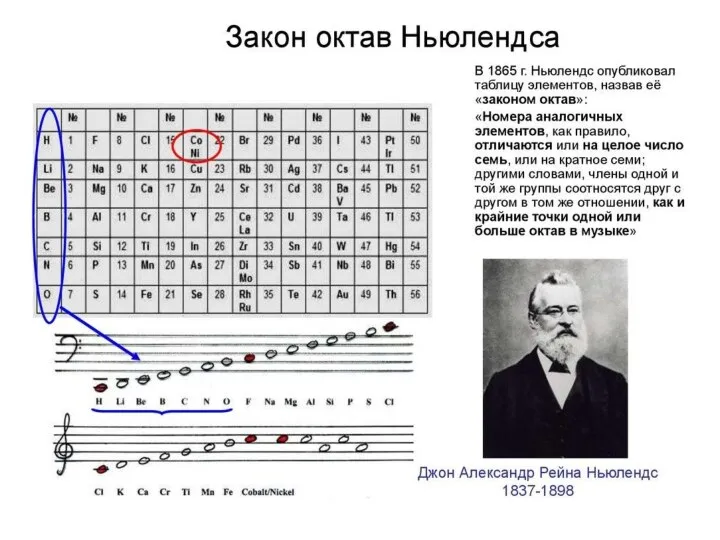
- 10. В общей сложности до Д.И. Менделеева было предпринято более 50 попыток классификации химических элементов. Ни одна
- 12. В основу своей работы по классификации химических элементов Д.И. Менделеев положил два их основных и постоянных
- 13. Что же было обнаружено? При переходе от лития к фтору происходит закономерное ослабление металлических свойств и
- 14. Если написать ряды химических элементов один под другим так, чтобы под литием находился натрий, а под
- 15. На основании своих наблюдений 1 марта 1869 г. Д.И. Менделеев сформулировал Периодический закон, который в начальной
- 16. Уязвимым моментом Периодического закона сразу после его открытия было объяснение причины периодического повторения свойств элементов с
- 17. Только с открытием строения атомного ядра и установлением физического смысла порядкового номера элемента стало понятно, что
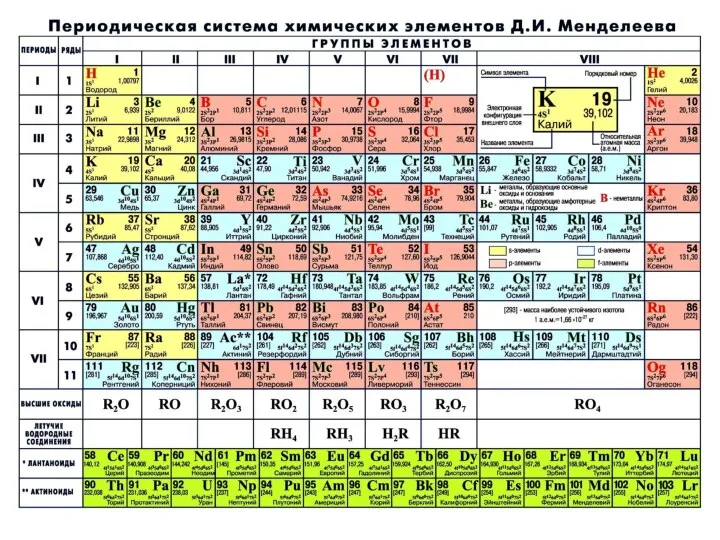
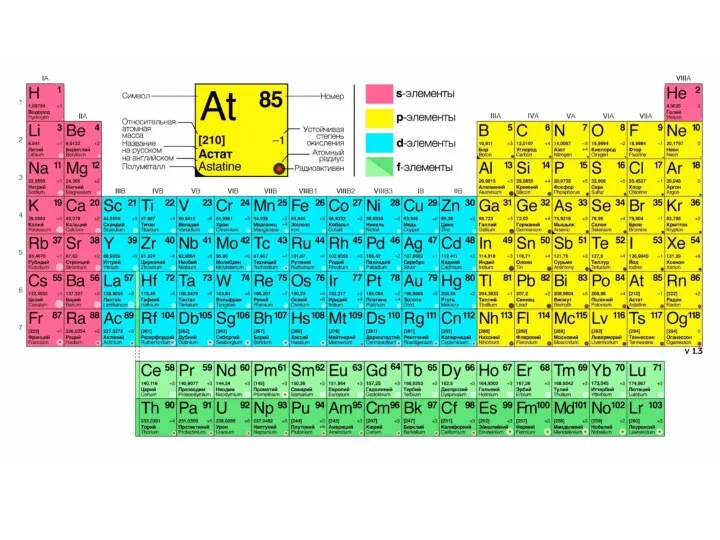
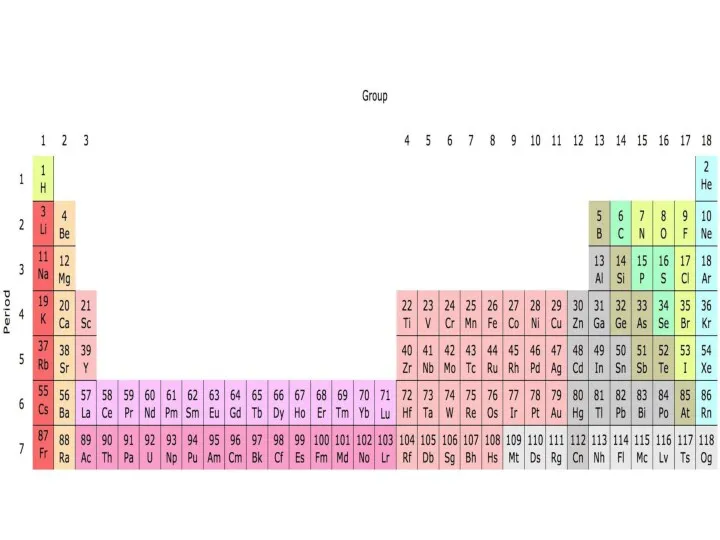
- 18. Структура Периодической системы химических элементов Д.И. Менделеева: Всего в Периодической системе 118 химических элементов, 94 из
- 22. Периоды - горизонтальные ряды химических элементов с одинаковым числом электронных уровней, равным номеру периода. Всего в
- 23. Группы - вертикальные столбцы элементов с одинаковым числом электронов на внешнем электронном уровне. Всего в Периодической
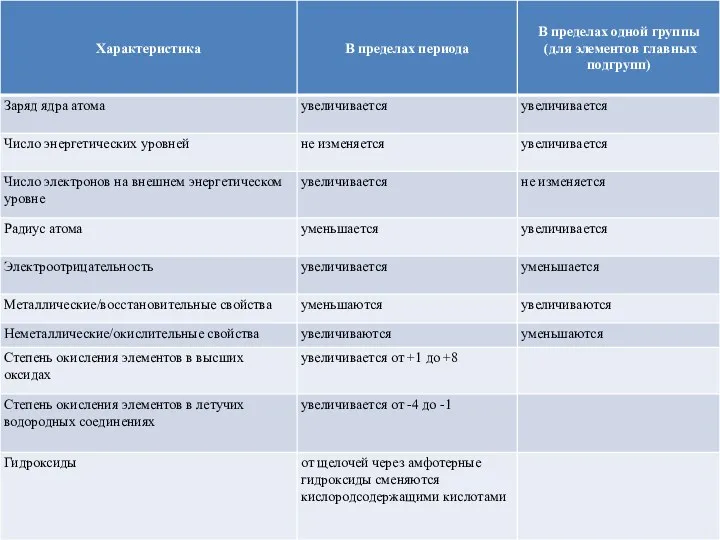
- 24. Закономерности изменения некоторых свойств химических элементов в Периодической системе
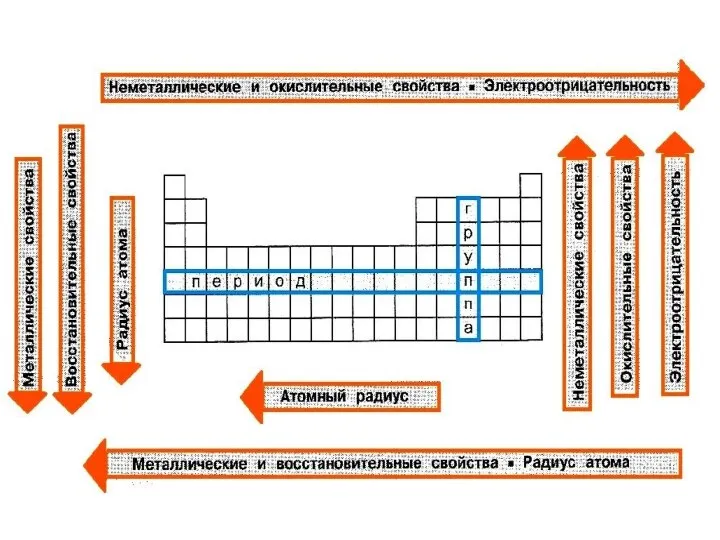
- 27. Изменение радиуса атома Радиус атома с увеличением зарядов ядер атомов в периоде уменьшается, т.к. притяжение ядром
- 28. Электроотрицательность Электроотрицательность - способность атомов оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у
- 29. Окислительно-восстановительные свойства Восстановительные свойства атомов (способность терять электроны при образовании химической связи) в главных подгруппах возрастают,
- 30. Металлические и неметаллические свойства Металлические свойства (способность атомов отдавать электроны) усиливаются в группах сверху вниз. В
- 31. Смысл и значение Периодического закона Открытый Д.И. Менделеевым Периодический закон и построенная на основе закона Периодическая
- 33. Скачать презентацию
























 Минерал турмалин
Минерал турмалин Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс
Пластмассы: свойства, требования, перспективы развития. Виды конструкций из пластмасс Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты
Лекарственные средства, относящиеся к производным пиридина : производные никотиновой и изоникотиновой кислоты Искусственные полимеры. 10 класс
Искусственные полимеры. 10 класс Теория химического строения органических соединений
Теория химического строения органических соединений Роль побутової хімії у житті
Роль побутової хімії у житті Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей
Методы чтения последовательностей нуклеиновых кислот. Секвенирование геномов древних людей альдегиды, свойства, получение
альдегиды, свойства, получение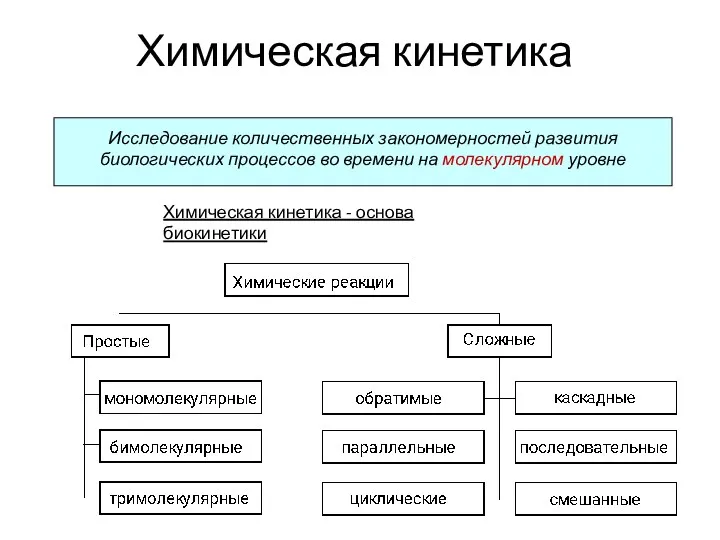 Химическая кинетика
Химическая кинетика Техника безопасности для учащихся в кабинете химии
Техника безопасности для учащихся в кабинете химии Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4)
Theories of acids and bases. Ionic equilibria in electrolyte solutions. Buffer solutions (topic 3.4) Химические и физические свойства воды
Химические и физические свойства воды Окислительно-восстановительные реакции. Готовимся к ЕГЭ
Окислительно-восстановительные реакции. Готовимся к ЕГЭ Ферменты в биотехнологии
Ферменты в биотехнологии Губна помада та ії призначення
Губна помада та ії призначення Анализ двойных диаграмм. Лабораторная работа
Анализ двойных диаграмм. Лабораторная работа Общая характеристика металлов
Общая характеристика металлов Азот и его соединения
Азот и его соединения Обобщение по типам химических реакций
Обобщение по типам химических реакций The production of stable isotopes
The production of stable isotopes Хімічні властивості насичених одноатомних спиртів. Одержання етанолу
Хімічні властивості насичених одноатомних спиртів. Одержання етанолу Protein Chemistry
Protein Chemistry Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау
Хинолин және хинуклидин, 4- жағдайда алмасқан хинолин туындыларының дәрілік заттарын талдау Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Лекция 1 эквивалент 2
Лекция 1 эквивалент 2 Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)