Содержание
- 2. Демокрит (V век до н.э.): Атом – мельчайшая неделимая частица вещества Канницаро (1860 г.): Атом –
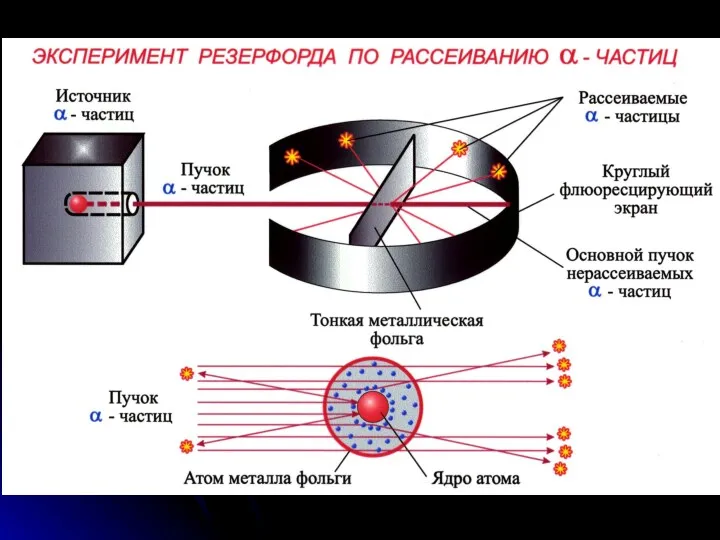
- 3. 1895 г – открытие рентгеновских лучей (Вильгельм Конрад Рентген) 1896 г – открытие радиоактивности (Антуан Беккерель)
- 4. Модель Томсона, 1903 г.: «Изюм в булке»
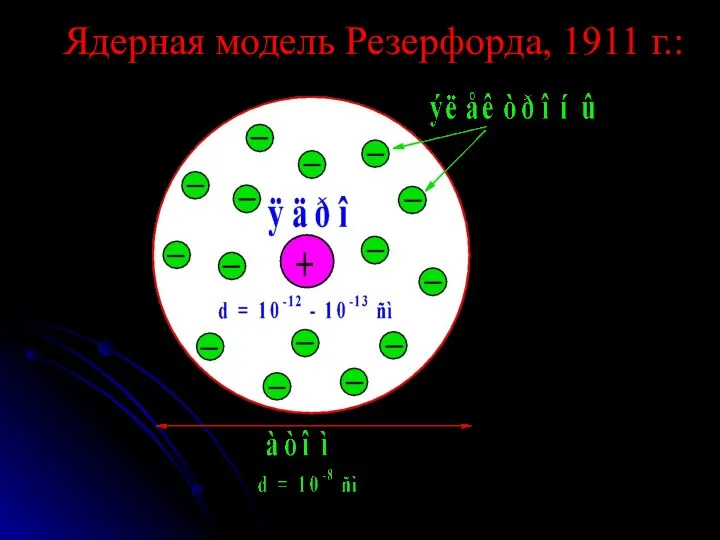
- 6. Ядерная модель Резерфорда, 1911 г.:
- 7. Макс Планк, 1900 г: Энергия испускается квантами! Уравнение Планка: Е = h⋅ν h − постоянная Планка,
- 8. Нильс Бор, 1913 г.: 1. Электрон может вращаться вокруг ядра только по стационарным круговым орбитам. 2.
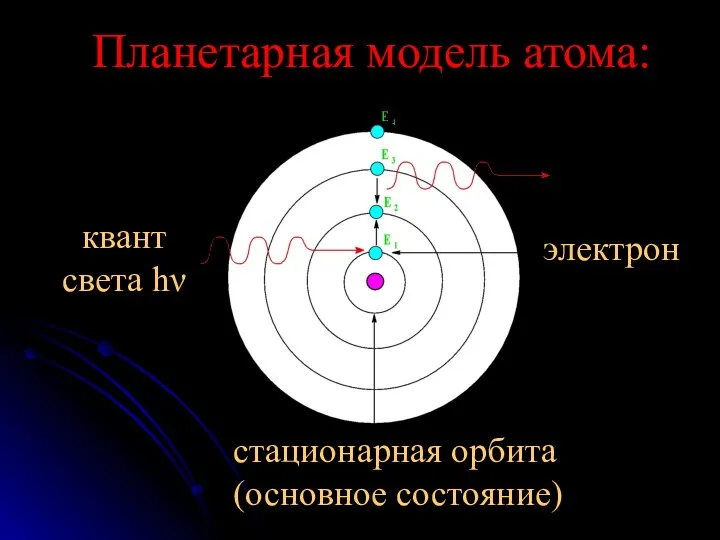
- 9. Планетарная модель атома: стационарная орбита (основное состояние) квант света hν электрон
- 10. Луи Де Бройль, 1924 г.: Материя обладает как корпускулярными, так и волновыми свойствами! Уравнение де Бройля:
- 11. Основы квантовой механики 1) Двойственная корпускулярно-волновая природа электрона; 2) Принцип неопределенности Гейзенберга: 3) Движение электрона в
- 12. Уравнение Шредингера: Волновую функцию ψ (х; y; z), определяющую область наиболее вероятного нахождения и энергетический уровень
- 13. Строение атомного ядра 1910 г. – открытие протона (Э. Резерфорд) 1932 г. – открытие нейтрона (Дж.
- 14. 1) Химический элемент однозначно характеризуется атомным номером Z, равным числу протонов в ядре. 2) Ядро с
- 15. Нуклиды с одинаковым числом Z называются изотопы. Нуклиды с одинаковым числом А называются изобары. Нуклиды с
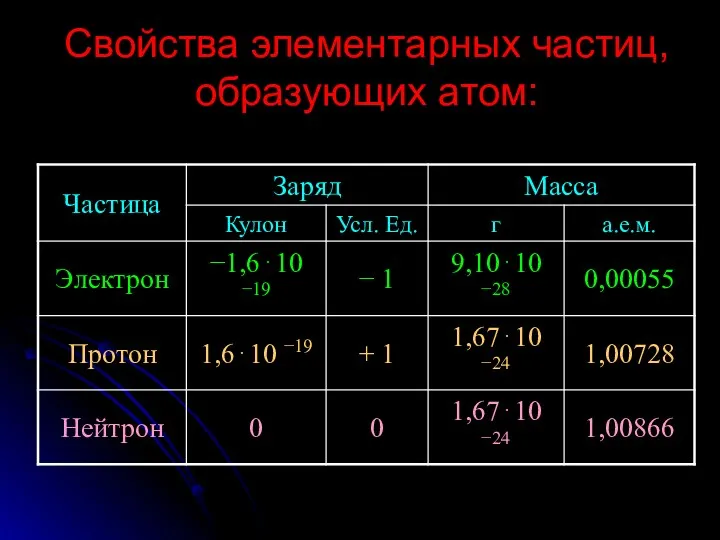
- 16. Свойства элементарных частиц, образующих атом:
- 17. Квантово-механическая модель атома n – главное квантовое число n = 1, 2, 3, 4 … ∞
- 18. l – орбитальное квантовое число l = 0, 1, … n – 1 n = 1
- 19. ml – магнитное квантовое число ml = − l …0 …+l l = 0 ⇒ ml
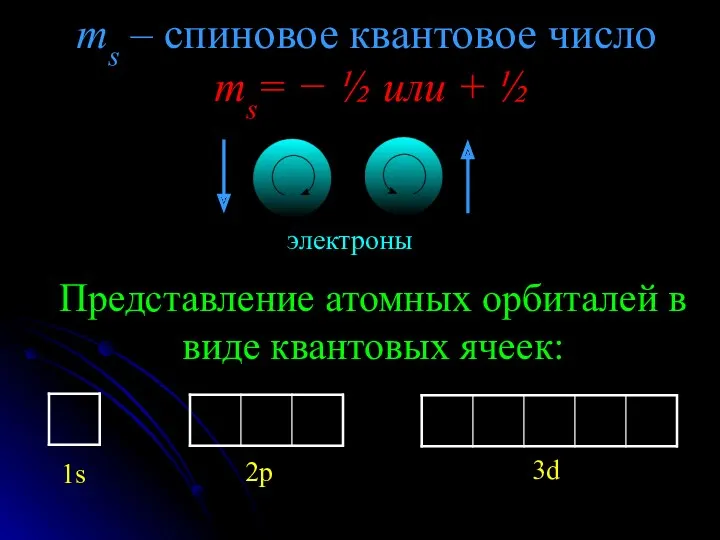
- 20. ms – спиновое квантовое число ms= − ½ или + ½ Представление атомных орбиталей в виде
- 21. Строение электронных оболочек атомов 1. Принцип Паули: Следствия: В атоме не может быть двух электронов с
- 22. 2. Правило Хунда: В пределах определенного подуровня электроны располагаются таким образом, чтобы суммарный спин был максимален
- 23. 3. Принцип наименьшей энергии: Каждый электрон занимает свободную орбиталь с самой низкой энергией Е ≅ n
- 24. 1H n = 1, l = 0, ml = 0, ms = ± ½ или 1s1
- 25. 4Be 1s22s2 5B 1s22s22p1 n = 2, l = 1, ml = −1, 0, +1 ms
- 26. 19K 1s22s22p63s23p6 ??? 3d: n + l = 3 + 2 = 5 4s: n +
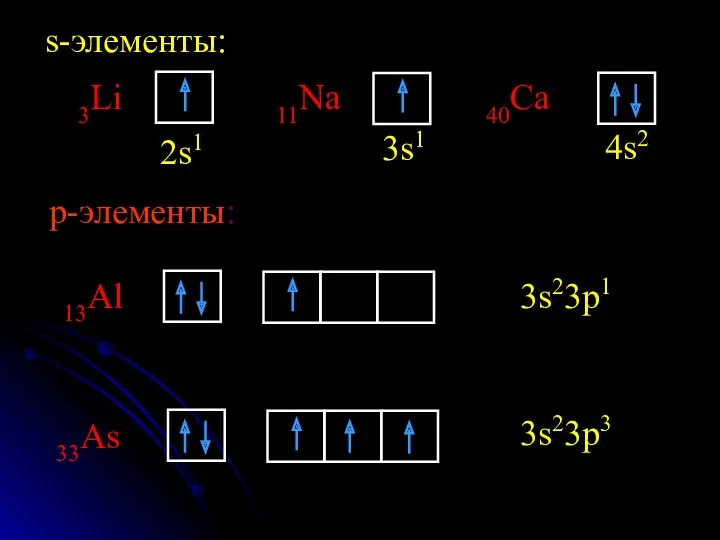
- 27. s-элементы: 3Li 2s1 11Na 3s1 40Ca 4s2 p-элементы: 13Al 3s23p1 33As 3s23p3
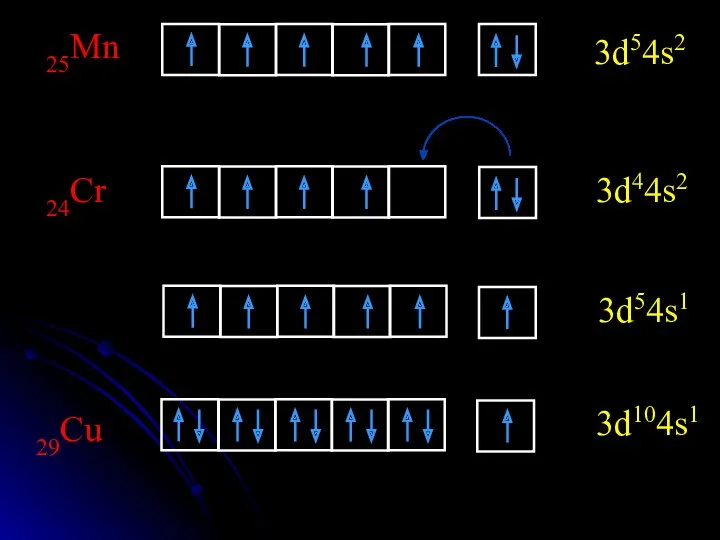
- 28. 25Mn 3d54s2 24Cr 3d44s2 3d54s1 29Cu 3d104s1
- 30. Скачать презентацию




















 Азот. Характеристика азота, фосфора (9класс)
Азот. Характеристика азота, фосфора (9класс) Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс
МОЛЯРНЫЙ ОБЪЕМ Химия 8 класс Тағам қоспалары
Тағам қоспалары Кaрбоновые кислоты
Кaрбоновые кислоты Индикаторные ошибки кислотно-основного титрования
Индикаторные ошибки кислотно-основного титрования Кислотно-основное титрование
Кислотно-основное титрование Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях Карбоновые кислоты. Уксусная кислота
Карбоновые кислоты. Уксусная кислота Подгруппа меди. Элементы 11 группы (Cu,Ag,Au)
Подгруппа меди. Элементы 11 группы (Cu,Ag,Au) Кремний и его соединения
Кремний и его соединения Хроматографические методы анализа
Хроматографические методы анализа Магматические горные породы
Магматические горные породы Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Химические свойства спиртов. Химические свойства предельных одноатомных спиртов
Химические свойства спиртов. Химические свойства предельных одноатомных спиртов Чистые вещества и смеси
Чистые вещества и смеси Маңызды химиялық өндірістер
Маңызды химиялық өндірістер Характеристика элементов VIII-В группы. Семейство железа
Характеристика элементов VIII-В группы. Семейство железа Щелочные металлы и их соединения. 9 класс
Щелочные металлы и их соединения. 9 класс Основные интермедиаты в органических реакциях. Часть 1
Основные интермедиаты в органических реакциях. Часть 1 Твердое состояние вещества. Плавление
Твердое состояние вещества. Плавление Вуглеводи прості і складні
Вуглеводи прості і складні Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества
Д.И. Менделеев Мощь и сила науки во множестве фактов, цель – в обобщении этого множества Удобрения и их классификация
Удобрения и их классификация Кислоты НСL, H2 O, H2 CO3
Кислоты НСL, H2 O, H2 CO3 Выращивание кристаллов в домашних условиях
Выращивание кристаллов в домашних условиях АЛКАНЫ Строение молекулы метана.
АЛКАНЫ Строение молекулы метана. Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод