Содержание
- 2. * Предмет химической термодинамики Термодинамика (ТД) – наука о взаимопревращениях различных видов энергии в химических и
- 3. * Химическая ТД изучает: превращения энергии при химических реакциях; энергетические эффекты, сопровождающие различные физические и химические
- 4. * Основные понятия и определения ТД Объект исследования ТД - термодинамическая система – тело или совокупность
- 5. * Классификация систем По взаимодействию с окружающей средой: Изолированные – не обменивается с окружающей средой ни
- 6. * Классификация систем По агрегатному состоянию: Гомогенные – состоящие из одной фазы. Например, смесь идеальных газов,
- 7. * Совокупность всех физических и химических свойств системы характеризует ее состояние. Состояние системы характеризуется термодинамическими параметрами
- 8. * Термодинамические функции – переменные величины, которые не могут быть непосредственно измерены и зависят от параметров
- 9. * Термодинамическим процессом называется любое изменение параметров системы. В зависимости от условий протекания различают следующие виды
- 10. * В зависимости от способа проведения термодинамические процессы могут быть: Самопроизвольные (естественные) – происходят сами по
- 11. * Первый закон термодинамики Это закон сохранения энергии в изолированной системе. Энергия изолированной системы есть величина
- 12. * Внутренняя энергия U Характеризует общий запас энергии в системе, включает в себя все виды энергии
- 13. * Энергия может передаваться от одной системы к другой двумя путями: В виде теплоты Q: Δ
- 14. * При совершении работы A против внешних сил: А > 0 система совершает работу расширения; А
- 15. * Приложение первого закона ТД к различным процессам Изохорный процесс (V=const, dV=0, pΔV=0 ): Qv =
- 16. * Изобарный процесс (p=const, dp=0): Н = U + pV – энтальпия - Qр = Н2
- 17. * Термохимия Это применение первого начала термодинамики к химическим процессам. Термохимия – раздел физической химии, изучающий
- 18. * Основные термохимические законы Закон Лавуазье–Лапласа: Теплота разложения обратно пропорциональна теплоте образования СН4(г) → С(графит) +
- 19. * Термохимические уравнения Химические уравнения, в которых указаны тепловые эффекты реакций и агрегатные состояния веществ, называют
- 20. *
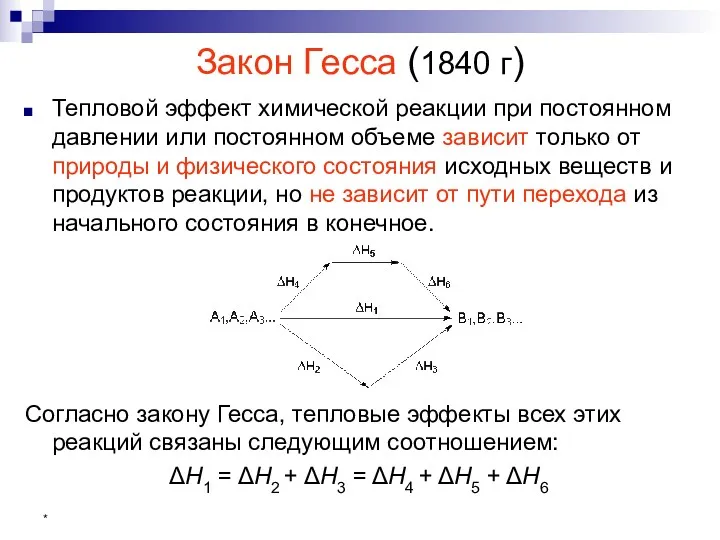
- 21. * Закон Гесса (1840 г) Тепловой эффект химической реакции при постоянном давлении или постоянном объеме зависит
- 22. * На основании закона Гесса с термохимическими уравнениями можно оперировать так же, как и с алгебраическими.
- 23. * Первое следствие закона Гесса: Энтальпия реакции равна сумме энтальпий образования продуктов за вычетом суммы энтальпий
- 24. * Задача 1. При взаимодействии кристаллического оксида алюминия и газообразного оксида серы(VI) получен кристаллический сульфат алюминия.
- 25. * Задача 2. Учитывая термохимическое уравнение реакции: Н2(г) + F2(г) = 2HF(г) Δr Н° = −
- 26. * Второе следствие закона Гесса: Энтальпия реакции равна сумме энтальпий сгорания исходных веществ за вычетом суммы
- 27. * Понятие об энтропии Состояние вещества можно охарактеризовать двояко: Указать конкретные значения измеряемых свойств, например, температуру
- 28. * Число микросостояний, с помощью которых можно осуществить данное макросостояние, - термодинамическая вероятность, WТ. Она связана
- 29. *
- 30. * Правило В изолированной системе самопроизвольные процессы происходят в направлении увеличения энтропии. ΔS ≥ 0 любая
- 31. * Изменение энтропии при различных процессах Нагревание вещества: ΔS > 0; Охлаждение: ΔS При Т→ абсолютный
- 32. * Сложность строения молекул: а) аллотропия – чем вещество тверже, тем меньше энтропия: S0(алмаз)= 2.37 Дж/моль×К
- 33. * Стандартная энтропия любого вещества всегда положительная величина (S0298 > 0). Стандартной энтропией S0298 называется энтропия
- 34. * Расчет энтропии S – термодинамическая функция состояния. Единицы измерения: [Дж/моль×К]. Изменение энтропии ΔS в каком
- 35. * Критерии направленности самопроизвольного процесса ΔS > 0 – в системе самопроизвольно протекает прямая реакция; ΔS
- 36. * Энергия Гиббса Для выяснения возможности протекания процессов в изобарно-изотермических условиях применяется термодинамическая функция энергия Гиббса
- 37. * В закрытой системе в изобарно-изотермических условиях знак изменения G - критерий направленности самопроизвольного процесса: ΔG
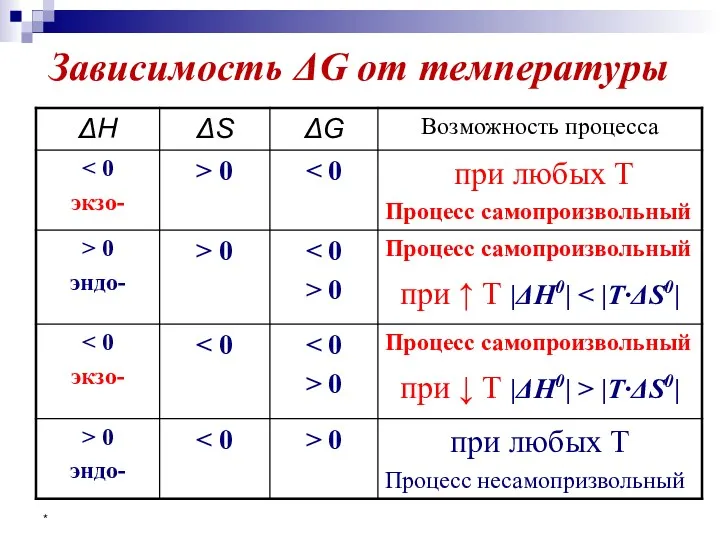
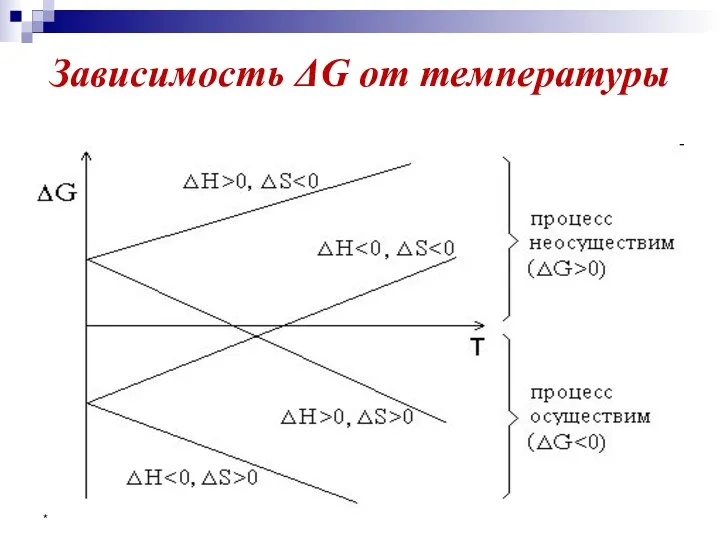
- 38. * Зависимость ΔG от температуры
- 39. * Зависимость ΔG от температуры
- 40. * Расчет энергии Гиббса Изменение энергии Гиббса можно вычислить по формуле: ΔG0Т = ΔH0298 - T·ΔS0298
- 41. * Химическое равновесие Большинство химический реакций обратимо, т.е. протекает одновременно в противоположных направлениях. 2Н2(г) + О2
- 42. * Термодинамическим равновесием называется такое термодинамическое состояние системы, которое при постоянстве внешних условий не изменяется во
- 43. * Количественной характеристикой химического равновесия является константа равновесия, которая может быть выражена через равновесные концентрации С,
- 44. * Уравнение изотермы химической реакции Устанавливает связь между ΔG0 и константой равновесия Кp В момент равновесия:
- 45. * Зависимость Кр от температуры По уравнению изотермы можно рассчитать Кр: Кр = exp(- ΔG0 /
- 47. Скачать презентацию









































 Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Соединения щелочных металлов
Соединения щелочных металлов Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ
Об изучении окислительно-восстановительных реакций в школьном курсе химии. Степени окисления атомов и формулы веществ Відносна молекулярна маса речовини, її обчислення за хімічною формулою
Відносна молекулярна маса речовини, її обчислення за хімічною формулою Алканы
Алканы Химические свойства основных классов неорганических веществ
Химические свойства основных классов неорганических веществ Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек
Дистиляттағы цианидтер, алифаттық қатардағы галоген туындылары, хлороформ, хлоралгидрат, төртхлорлы көміртек Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Предельные углеводороды
Предельные углеводороды Комплесные соединения
Комплесные соединения Мұнай. Мұнайдың шығу тарихы
Мұнай. Мұнайдың шығу тарихы Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты
Лекция 1. Периодический закон и периодическая система химических элементов. Индустрия красоты Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу
Салыстырмалы тығыздығы мен элементтердің массалық үлестері бойынша газ күйіндегі заттардың молекулалық формулаларын табу Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер
Алкалоидтар түсінігі. Никотин, кофеин,морфин, хинин туралы түсініктер Неметаллические материалы, используемые в машино- и приборостроении
Неметаллические материалы, используемые в машино- и приборостроении Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Алюминий и его соединения
Алюминий и его соединения Метаболизм нуклеиновых кислот
Метаболизм нуклеиновых кислот Азотистые гетероциклические соединения
Азотистые гетероциклические соединения Формы минералов и их агрегатов
Формы минералов и их агрегатов Химические свойства металлов
Химические свойства металлов Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі
Адсорбция-фазалар бөлу беттерінде жүретін бір компоненттің екінші компонентке сіңуі Угарный газ
Угарный газ Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия
Контрольная работа по дисциплине Физическая химия. Раздел: Электрохимия Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Ферум та його сполуки
Ферум та його сполуки Аминокислоты. Белки
Аминокислоты. Белки