Содержание
- 2. По основности: одноосновная По содержанию «О»: кислородсодержащая По растворимости в воде: растворимая По силе электролита: сильная
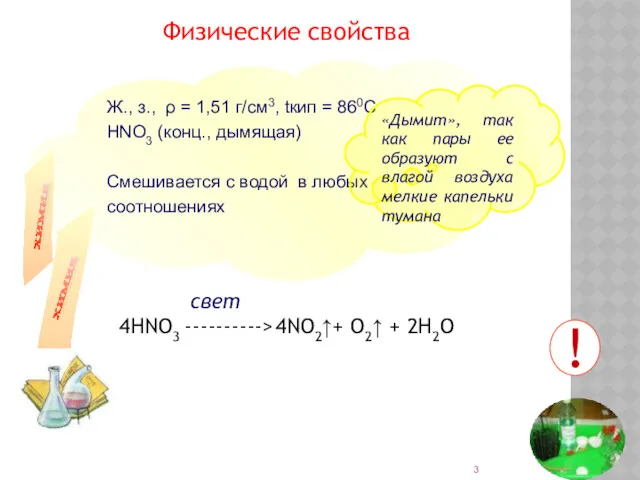
- 3. Ж., з., ρ = 1,51 г/см3, tкип = 860С НNO3 (конц., дымящая) Смешивается с водой в
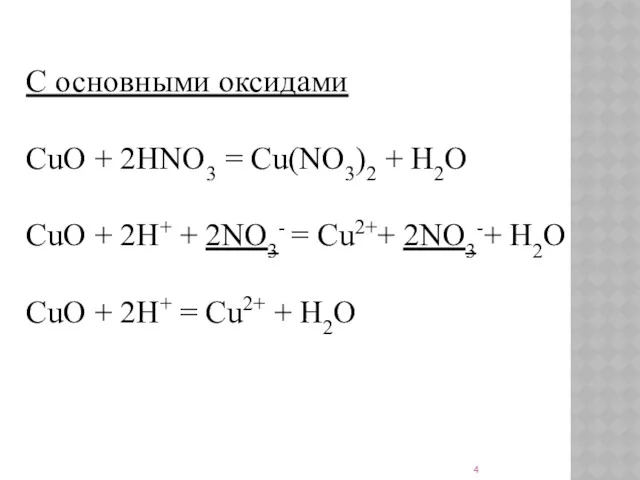
- 4. С основными оксидами CuO + 2HNO3 = Cu(NO3)2 + H2O CuO + 2H+ + 2NO3- =
- 5. С основаниями (нерастворимыми): Cu(OH)2 + 2HNO3 = Cu(NO3)2 + 2H2O Cu(OH)2 + 2H++ 2NO 3- =
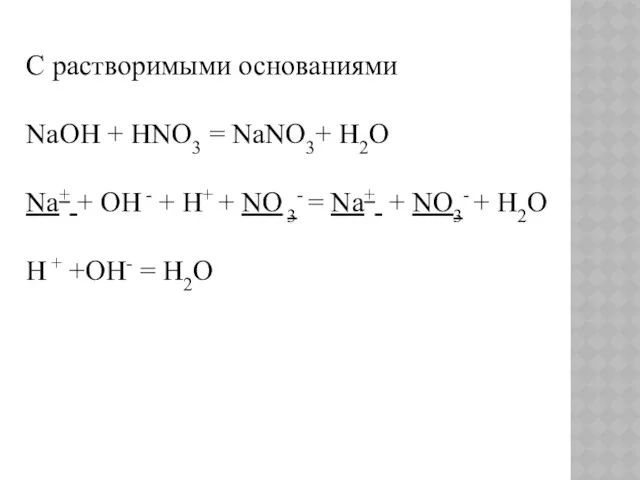
- 6. С растворимыми основаниями NaOH + HNO3 = NaNO3+ H2O Na+ + OH - + H+ +
- 7. C солями (более слабых кислот): Na2CO3 + 2HNO3 = 2NaNO3 + CO2+ H2O 2Na+ + CO32
- 8. Разбавленная азотная кислота проявляет все свойства кислот: 1. Взаимодействует с основными и амфотерными оксидами. 2. Взаимодействует
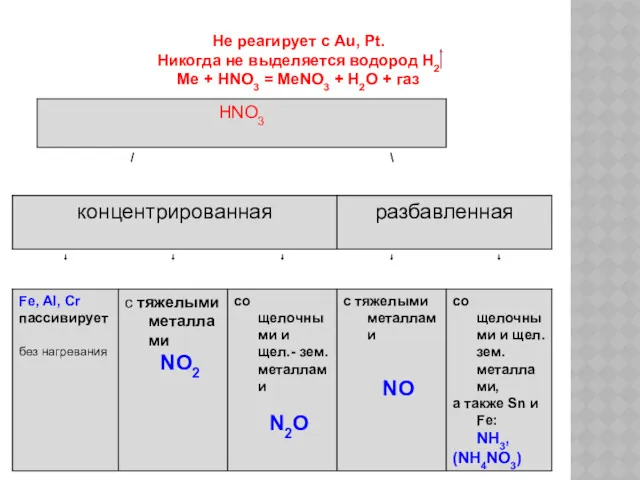
- 9. Не реагирует с Au, Pt. Никогда не выделяется водород H2 Me + HNO3 = MeNO3 +
- 10. Cu + HNO3 (конц) = Cu(NO3)2 + NO2 ↑ + H2O Cu + HNO3 (разб) =
- 11. РАЗБАВЛЕННАЯ АЗОТНАЯ КИСЛОТА РЕАГИРУЕТ С КАЖДЫМ ВЕЩЕСТВОМ РЯДА: А) SiO2, Cu(OH)2, Na2CO3 Б) Na2CO3, Al2O3, Ag
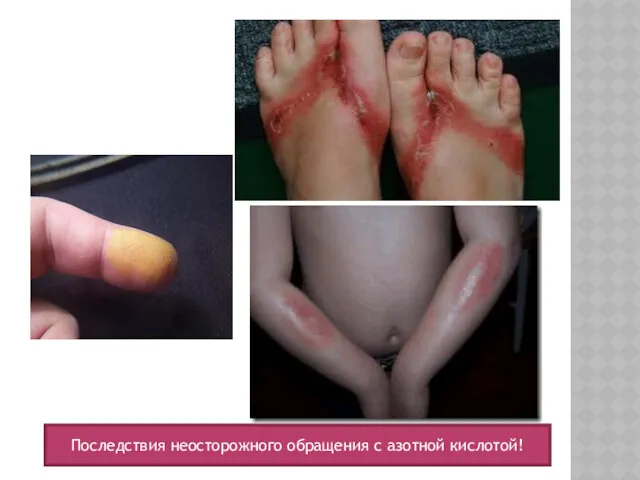
- 12. Последствия неосторожного обращения с азотной кислотой!
- 13. Получение ГЛАУБЕР Иоганн Рудольф (1604-1670), немецкий химик и врач. Получил чистую азотную кислоту в 1650 году.
- 14. При каталитическом окислении бесцветного, ядовитого газа А с характерным резким запахом образуется вещество Б. Вещество Б
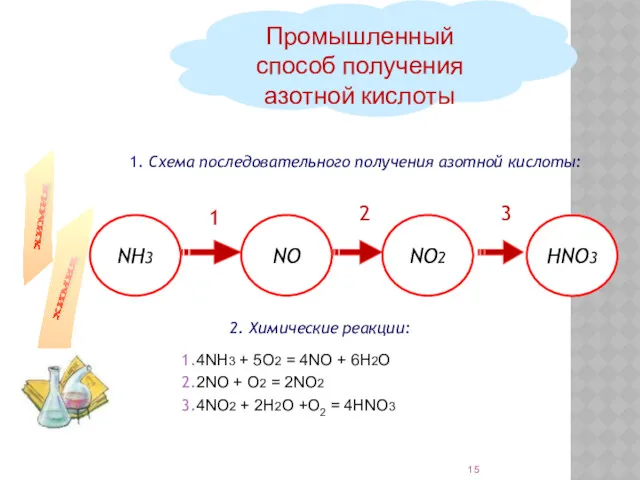
- 15. 1. Схема последовательного получения азотной кислоты: Промышленный способ получения азотной кислоты 2. Химические реакции: 1 2
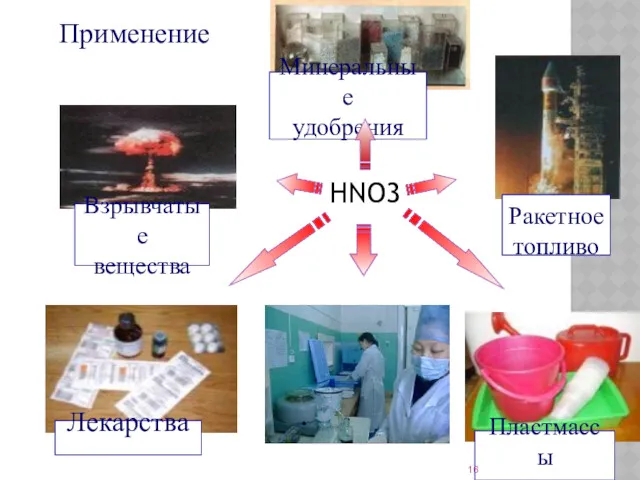
- 16. Применение HNO3
- 17. Согласны ли вы со следующими утверждениями: ? 1. Азотная кислота является сильным окислителем. 2. Азотная кислота
- 19. Скачать презентацию




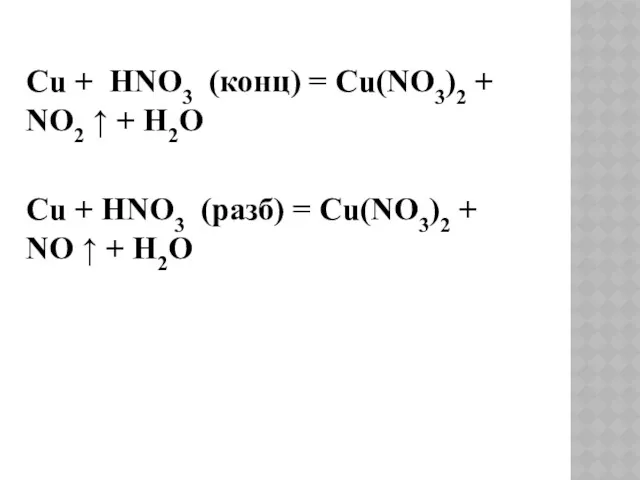




 Фосфор
Фосфор Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Білки та амінокислоти
Білки та амінокислоти Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ
Рекомендации по оформлению развёрнутых ответов на задания ЕГЭ Строение, свойства и применение алкенов
Строение, свойства и применение алкенов Природные источники углеводородов. 10 класс
Природные источники углеводородов. 10 класс Высокоэффективная жидкостная хроматография
Высокоэффективная жидкостная хроматография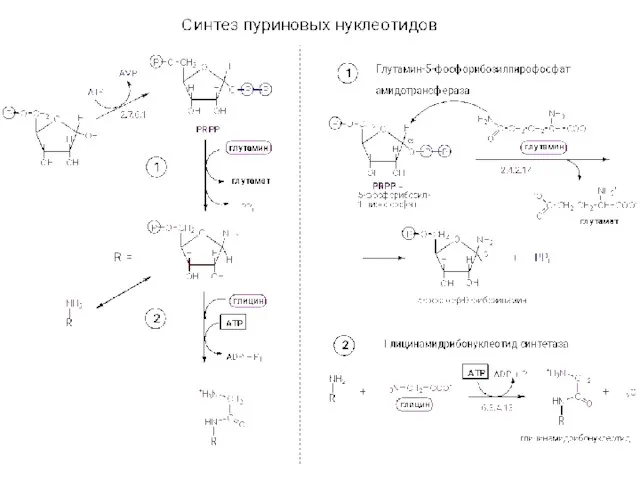 Синтез нуклеотидов
Синтез нуклеотидов Комплексные соединения и лигандообменные равновесия
Комплексные соединения и лигандообменные равновесия Хімічні властивості металів
Хімічні властивості металів Азот
Азот Валентность. Определение валентности по формулам. Химия. 8 класс
Валентность. Определение валентности по формулам. Химия. 8 класс Твердотільний ямр
Твердотільний ямр Спирти
Спирти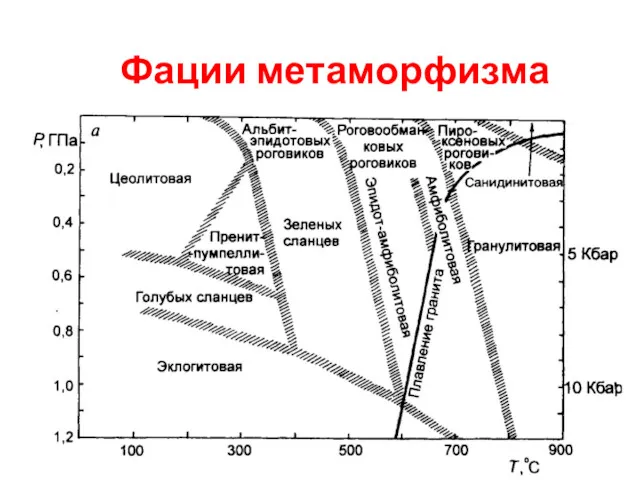 Фации метаморфизма
Фации метаморфизма Изучение зависимости между химическим составом, структурой и свойствами чугунов
Изучение зависимости между химическим составом, структурой и свойствами чугунов Прості й складні речовини. Хімічні формули. Метали і неметали
Прості й складні речовини. Хімічні формули. Метали і неметали Теоретические аспекты химического осаждения из газовой фазы
Теоретические аспекты химического осаждения из газовой фазы Промышленное производство аммиака
Промышленное производство аммиака Тяжёлая вода
Тяжёлая вода Свойства воды. Гидросфера
Свойства воды. Гидросфера Методы комплексонометрии. Количественный анализ
Методы комплексонометрии. Количественный анализ Кінетика хімічних реакцій і хімічна рівновага
Кінетика хімічних реакцій і хімічна рівновага Пищевые добавки
Пищевые добавки Лекции по курсу конструкционные и биоматериалы
Лекции по курсу конструкционные и биоматериалы Подгруппа серы и ее соединения
Подгруппа серы и ее соединения Особенности сжигания газообразного топлива и топливосжигающие устройства
Особенности сжигания газообразного топлива и топливосжигающие устройства Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3
Периодический закон и периодическая система элементов Д.И. Менделеева. Лекция 3