Содержание
- 2. План лекции: Современные представления о строении и свойствах комплексных соединений. Биологическая роль и применение в медицине
- 3. Реагенты в аналитической химии Катализаторы Лекарственные препараты Витамины Хлорофилл Гемоглобин И др.
- 4. Комплексные соединения - устойчивые химические соединения сложного состава, в которых имеется хотя бы одна связь, образованная
- 5. Альфред Вернер (12.09 1886 — 15.11. 1919) Швейцарский химик, создатель координационной теории, которая легла в основу
- 6. Составные части комплексных соединений [Co3+ (NH3) 6]3+Cl3 Центральный атом Лиганды Ион внешней сферы Внутреняя сфера Внешняя
- 7. Центральный ион–комплексообразователь– акцептор электронов ( кислота Льюиса) Лиганды внутренней сферы- доноры электронов ( основания Льюиса) Связь
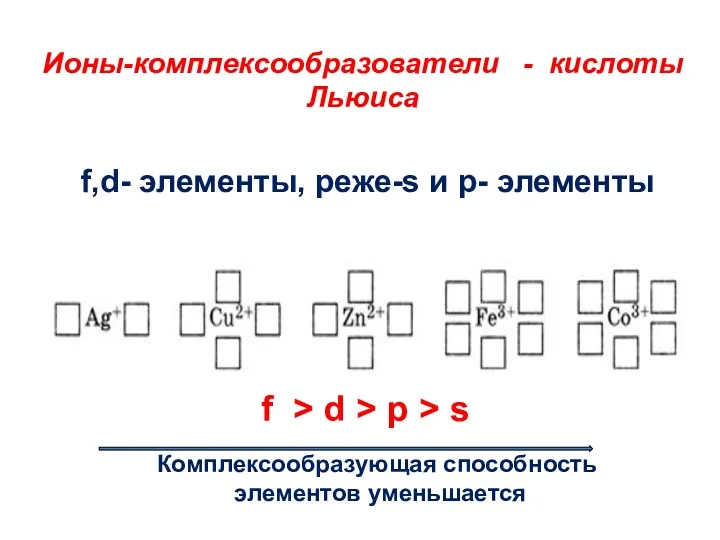
- 8. Ионы-комплексообразователи - кислоты Льюиса f,d- элементы, реже-s и р- элементы f > d > p >
- 9. Характеристика центрального атома (иона)-комплексообразователя Координационное число- это число атомов или групп атомов, непосредственно связанных с комплексообразователем.
- 10. чаще всего кч устойчивого комплекса в два раза больше степени окисления ц.а. КЧ = 2Z Эмпирическое
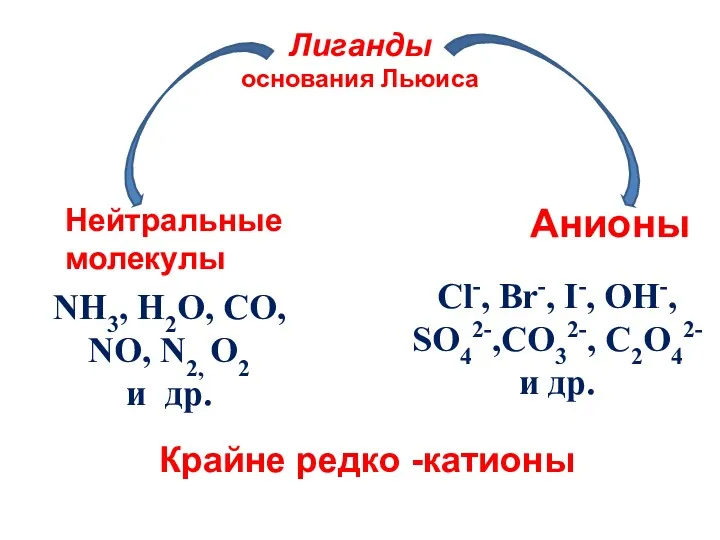
- 11. Лиганды основания Льюиса NH3, H2O, CO, NO, N2, O2 и др. Cl-, Br-, I-, OH-, SO42-,CO32-,
- 12. -монодентатные лиганды, содержат один донорный атом .. .. .. .. .. H2O NH3 OH- Cl- Br
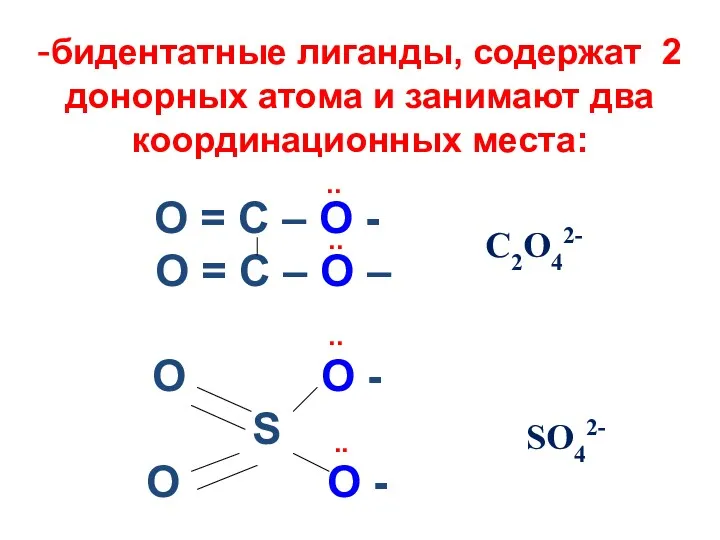
- 13. -бидентатные лиганды, содержат 2 донорных атома и занимают два координационных места: О = С – О
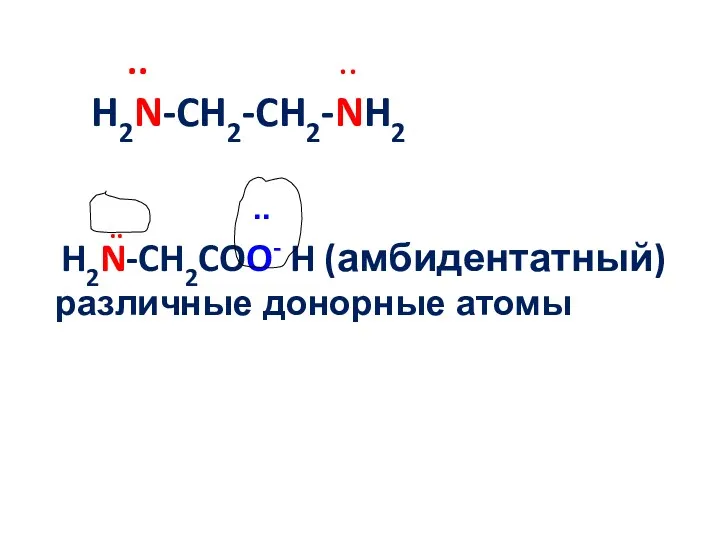
- 14. .. .. H2N-CH2-CH2-NH2 .. H2N-CH2COO- H (амбидентатный) различные донорные атомы ..
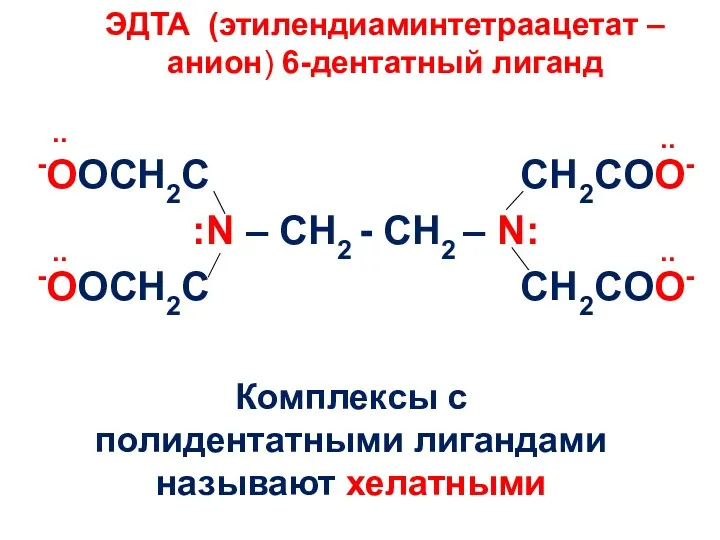
- 15. ЭДТА (этилендиаминтетраацетат –анион) 6-дентатный лиганд -OOCH2C CH2COO- :N – CH2 - CH2 – N: -OOCH2C CH2COO-
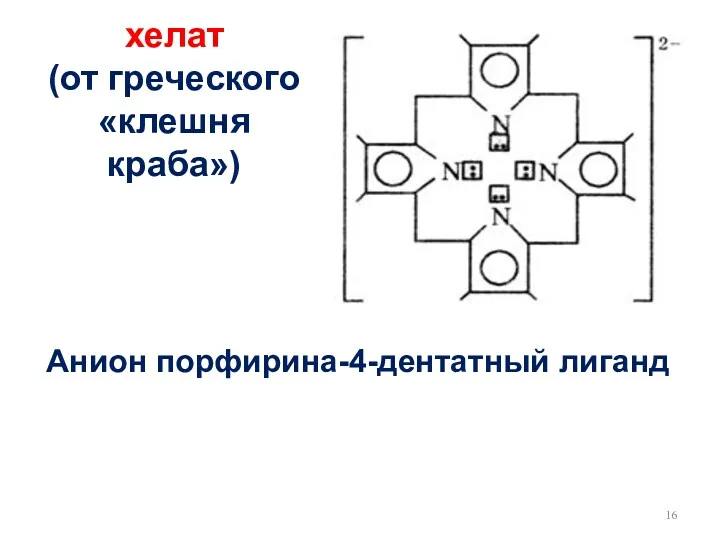
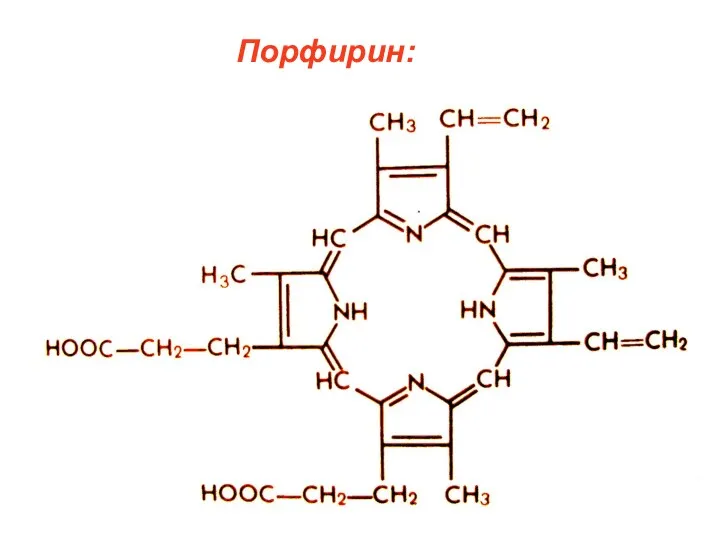
- 16. Анион порфирина-4-дентатный лиганд хелат (от греческого «клешня краба»)
- 17. Наиболее устойчивые 5-ти и 6- членные лиганды (правило Чугаева) Лев Алекса́ндрович Чуга́ев (4(16).10. 1873 — 23.09
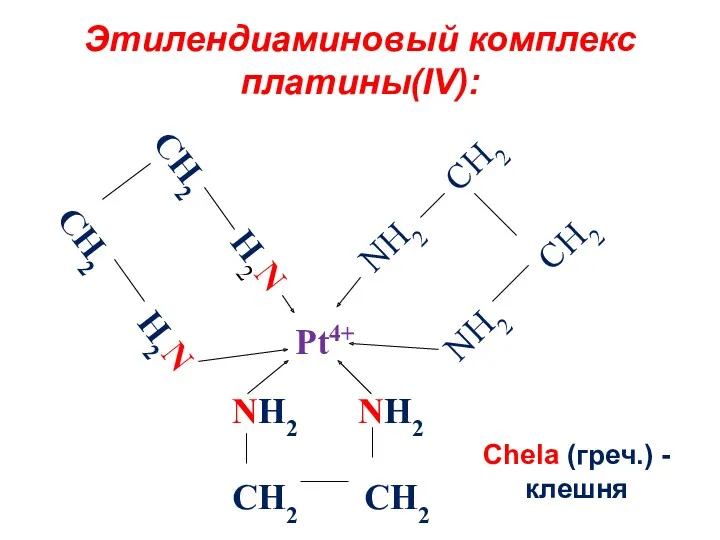
- 18. Этилендиаминовый комплекс платины(IV): Chela (греч.) - клешня
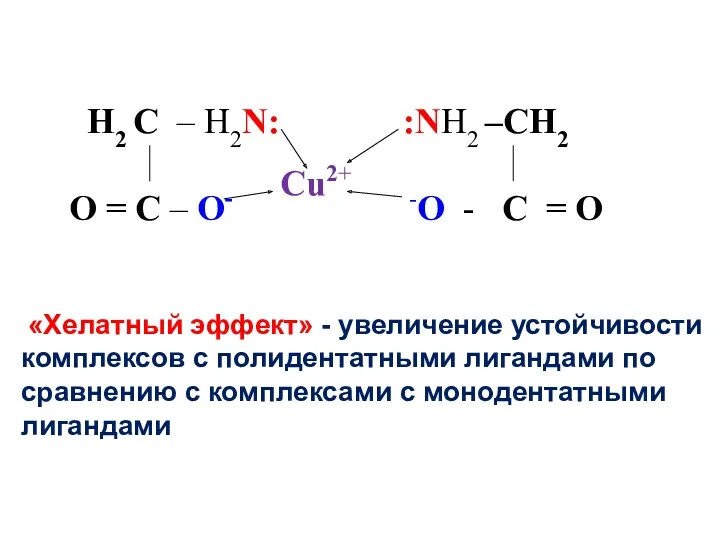
- 19. «Хелатный эффект» - увеличение устойчивости комплексов с полидентатными лигандами по сравнению с комплексами с монодентатными лигандами
- 20. Эффективность донорно-акцепторного взаимодействия лиганда и комплексообразователя, а, следовательно, и прочность связи между ними определяется их поляризуемостью
- 21. Жесткие и мягкие кислоты и основания ЖМКО Кислоты (по Льюису) – акцепторы электронов Al3+, Fe3+, Pb2+
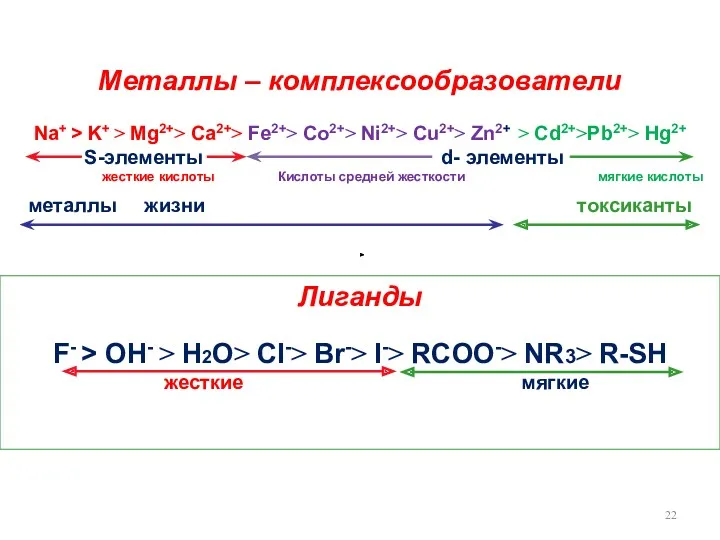
- 22. Лиганды F- > OH- > H2O> CI-> Br-> I-> RCOO-> NR3> R-SH жесткие мягкие Металлы –
- 23. [Ag(NH3)2] CI
- 24. Константа нестойкости и константа устойчивости [Ag(NH3)2] СI [Ag(NH3)2]+ + CI- 1. Первичная диссоциация (по типу сильных
- 25. Константа нестойкости и константа устойчивости 2. Вторичная диссоциация( по типу слабых электролитов, ступенчато) Кн1 [Ag(NH3)2]+ [AgNH3]+
- 26. 2. Вторичная диссоциация Кн 2 [AgNH3]+ Ag+ + NH3
- 27. Суммарно: Кн [Ag(NH3)2]+ Ag+ + 2NH3
- 28. Общая константа нестойкости Кн = Кн1 · Кн2 Чем меньше Кн, тем комплекс прочнее Константа устойчивости
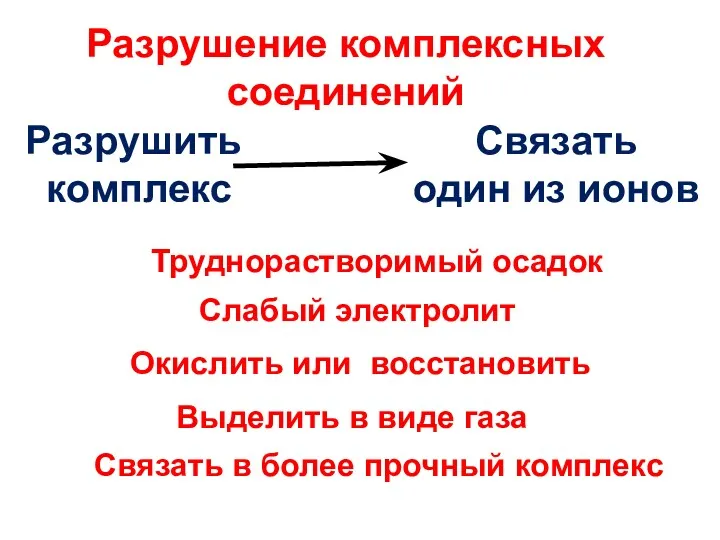
- 29. Разрушение комплексных соединений Труднорастворимый осадок Слабый электролит Окислить или восстановить Выделить в виде газа Связать в
- 30. [Ag (NH3)2]+↔ Ag+ + 2 NH3 [Ag(CN)2]-
- 31. [Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ KsAgI [Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3 Кн [Ag(CN)2]-
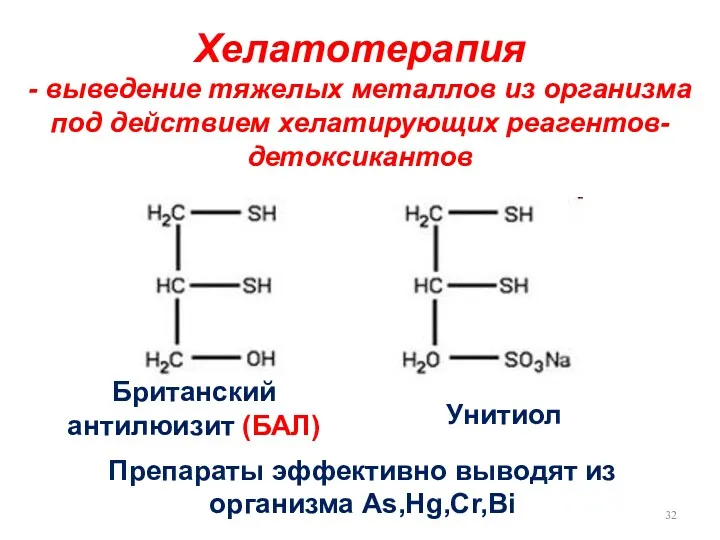
- 32. Хелатотерапия - выведение тяжелых металлов из организма под действием хелатирующих реагентов- детоксикантов Британский антилюизит (БАЛ) Унитиол
- 33. ЭДТА и его производные (Na2ЭДТА или трилон Б) используются при почечно-каменной болезни и при отравлениях тяжелыми
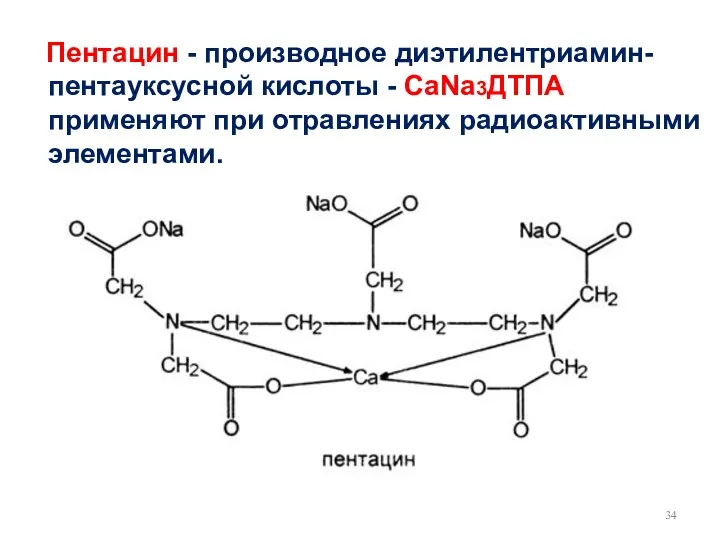
- 34. Пентацин - производное диэтилентриамин- пентауксусной кислоты - СаNа3ДТПА применяют при отравлениях радиоактивными элементами.
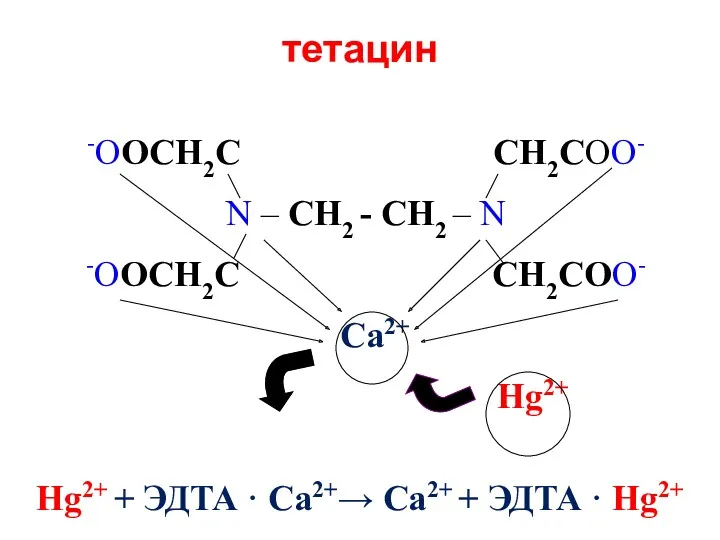
- 35. Для детоксикации организма при отравлении металлами-токсикантами (свинца, ртути, кадмия, урана) используют препарат тетацин-кальций (Nа2СаЭДТА), имеющий низкое
- 36. тетацин -OOCH2C CH2COO- N – CH2 - CH2 – N -OOCH2C CH2COO- Сa2+ Hg2+ Hg2+ +
- 37. Принципы хелатотерапии Детоксикант (лиганд) должен эффективно связывать ионы-токсиканты то есть…!!!!!! - вновь образующиеся соединения должны быть
- 38. Антидоты: унитиол БАЛ ЭДТА, Na2ЭДТА, Na2CaЭДТА
- 39. Биологическое значение комплексов: 2. Сu2+-содержащий комплекс - супероксиддисмутаза (СОД) препятствует накоплению в организме свободных радикалов. 1.Ионы
- 40. Порфирин:
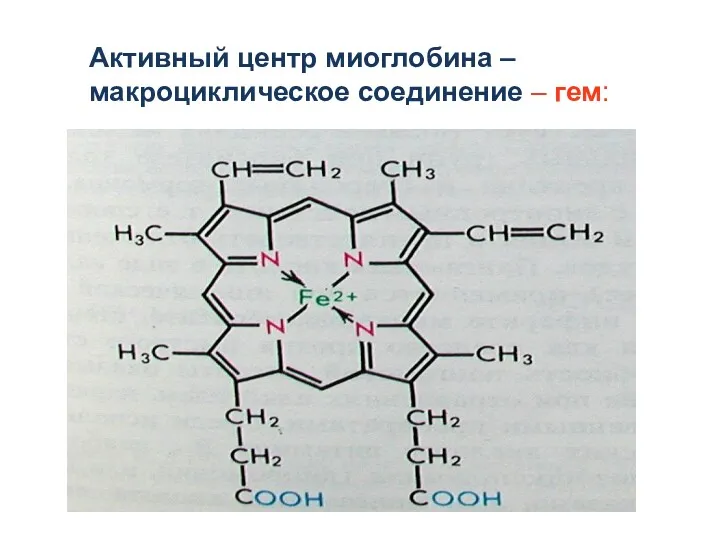
- 41. Активный центр миоглобина – макроциклическое соединение – гем:
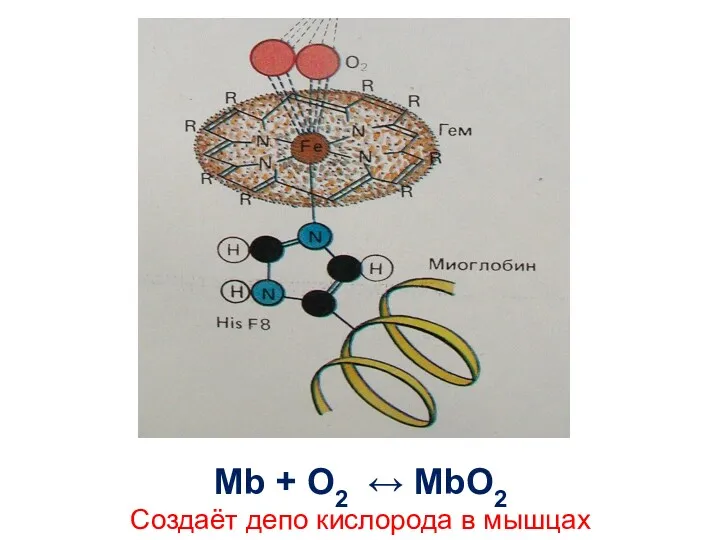
- 42. Mb + O2 ↔ MbO2 Создаёт депо кислорода в мышцах
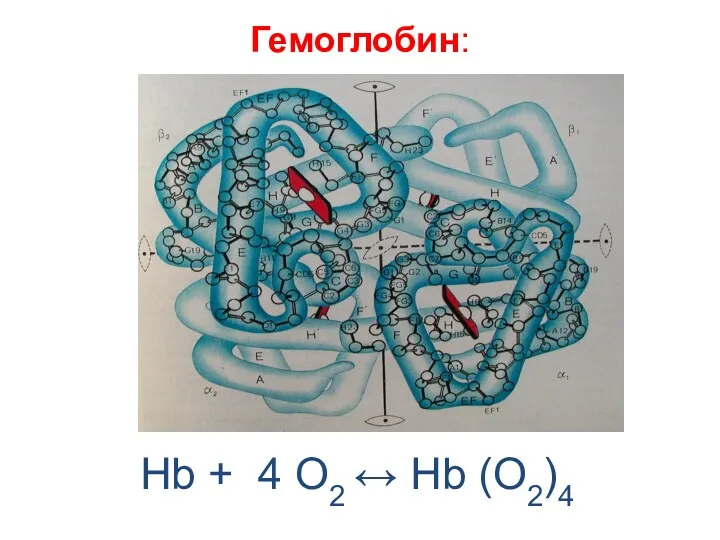
- 43. Гемоглобин: Hb + 4 O2 ↔ Hb (O2)4
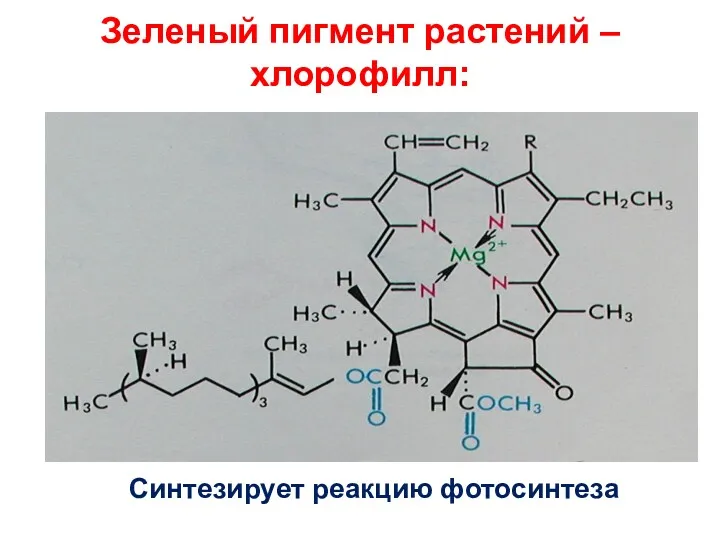
- 44. Зеленый пигмент растений –хлорофилл: Синтезирует реакцию фотосинтеза
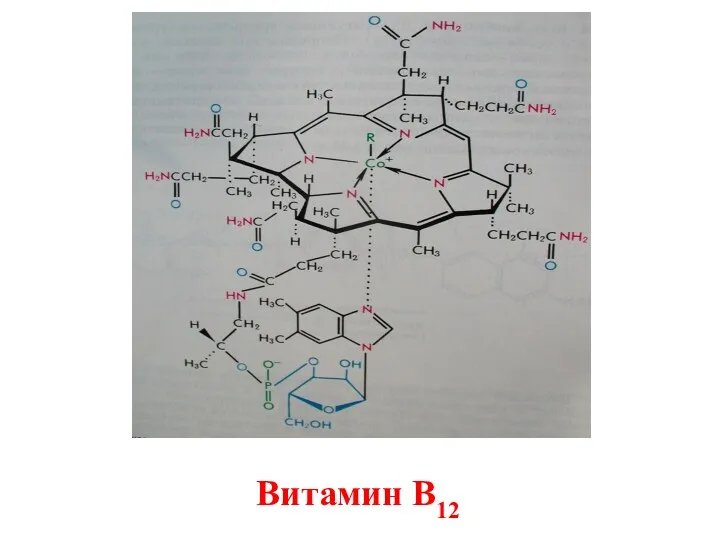
- 45. Витамин В12
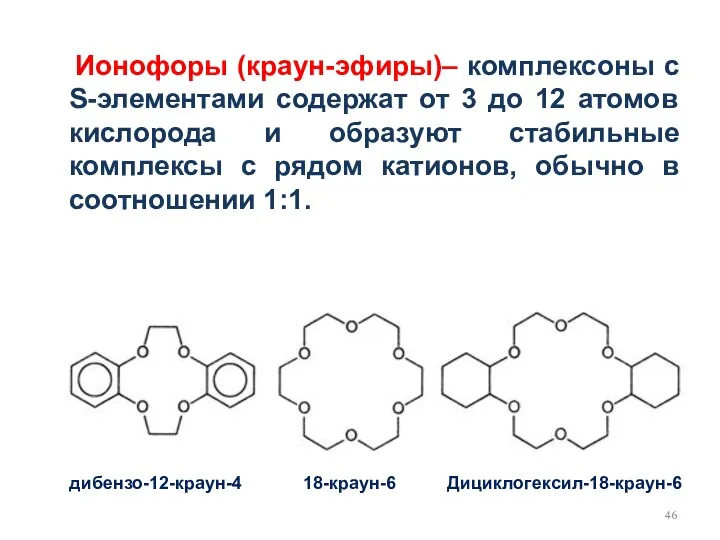
- 46. Ионофоры (краун-эфиры)– комплексоны с S-элементами содержат от 3 до 12 атомов кислорода и образуют стабильные комплексы
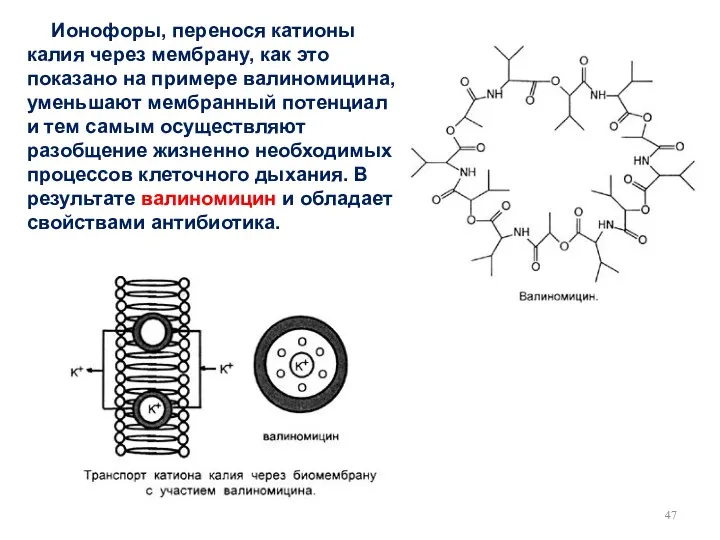
- 47. Ионофоры, перенося катионы калия через мембрану, как это показано на примере валиномицина, уменьшают мембранный потенциал и
- 48. -противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]
- 50. Скачать презентацию




![Составные части комплексных соединений [Co3+ (NH3) 6]3+Cl3 Центральный атом Лиганды](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-5.jpg)







![[Ag(NH3)2] CI](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-22.jpg)
![Константа нестойкости и константа устойчивости [Ag(NH3)2] СI [Ag(NH3)2]+ + CI-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-23.jpg)

![2. Вторичная диссоциация Кн 2 [AgNH3]+ Ag+ + NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-25.jpg)
![Суммарно: Кн [Ag(NH3)2]+ Ag+ + 2NH3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-26.jpg)

![[Ag (NH3)2]+↔ Ag+ + 2 NH3 [Ag(CN)2]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-29.jpg)
![[Ag (NH3)2]++ KI =AgI↓+ NH3 +K+ KsAgI [Ag (NH3)2]++2CN- = [Ag(CN)2]- +2NH3 Кн [Ag(CN)2]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-30.jpg)





![-противоопухолевый препарат: цис-изомер дихлородиамминплатины (цис-платин) цис- [Pt(NH3)2Cl2] цис- [Pt(NH3)4Cl2]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/121562/slide-47.jpg)
 Історія відкриття періодичної системи хімічних елементів
Історія відкриття періодичної системи хімічних елементів Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2
Chemical reaction rate. Influence of conditions on the rate of chemical reactions. Catalysis. Topic 3.2 Щавелевая кислота
Щавелевая кислота Химическая связь
Химическая связь Переработка тяжелых нефтей, битумов и нефтяных остатков
Переработка тяжелых нефтей, битумов и нефтяных остатков Дистилляция в химической промышленности
Дистилляция в химической промышленности Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию Соли
Соли Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Методы сжигания газа. Раздел 3
Методы сжигания газа. Раздел 3 Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Кислородные соединения углерода
Кислородные соединения углерода Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Лекарства дома
Лекарства дома Каменный уголь. Фенол
Каменный уголь. Фенол Коллигативные свойства растворов
Коллигативные свойства растворов Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Адсорбция. Раздел III
Адсорбция. Раздел III Литий. Физические свойства лития
Литий. Физические свойства лития Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Тяжелые металлы. Опасность токсичных металлов для организма
Тяжелые металлы. Опасность токсичных металлов для организма Медико-биологическое значение неметаллов. Йод
Медико-биологическое значение неметаллов. Йод Атомы и молекулы
Атомы и молекулы Типы химических реакций
Типы химических реакций