Содержание
- 2. Цели занятия систематизировать теоретические знания по теме «Типы химических реакций»; усовершенствовать практические навыки работы с лабораторной
- 3. Химическая разминка Что такое химические явления? Чем они отличаются от физических? Укажите известные вам признаки химических
- 4. Работа с химическими уравнениями ΗgO → Ηg + O2 Сu(OH)2 + HCI → H2O + CuCI2
- 5. Реакции соединения это такие реакции, при которых из двух и более веществ образуется одно сложное вещество.
- 6. Реакции замещения это такие реакции, в результате которых атомы простого вещества замещают атомы одного из элементов
- 7. Реакции обмена это такие реакции, при которых два сложных вещества обмениваются своими составными частями. Сu(OH)2 +
- 8. Реакции разложения это такие реакции, при которых из одного сложного вещества образуется несколько новых веществ. 2ΗgO
- 9. Экзотермические реакции Реакции, протекающие с выделением теплоты 4Al+3O2=2Al2O3+Q СН4(г) + 2О2(г) = СО2(г) + 2Н2О(г) +
- 10. Эндотермические реакции химическая реакция, при которой происходит поглощение теплоты. CaCO3(кр) = CaO(кр) +CO2(г) – Q 2HgO(кр)
- 11. Гомогенные реакции реакции, протекающие в системе, состоящей из одной фазы (в однородной среде) 2NO(газ) + O2(газ)
- 12. Гетерогенные реакции реакции, протекающие на границе раздела фаз. Zn(тв.) + H2SO4(раствор) = ZnSO4 + H2 CaCO3(тв.)
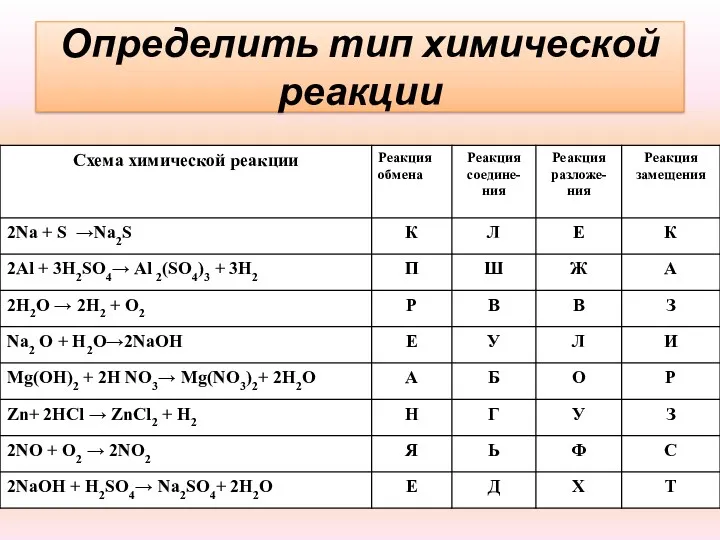
- 13. Определить тип химической реакции
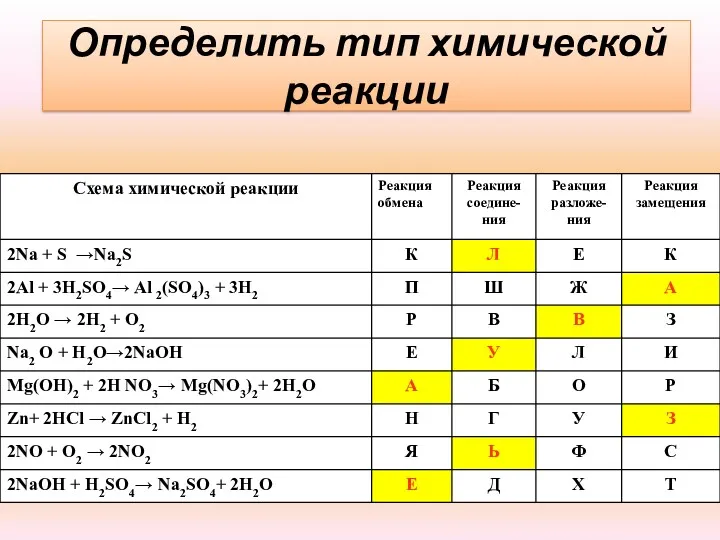
- 14. Определить тип химической реакции
- 15. Михаил Васильевич Ломоносов Антуан Лоран Лавуазьє
- 16. Тест по теме: «Типы химических реакций» 1-й уровень 1. Уравнение реакции замещения: а) Zn + 2HCl
- 17. 1. Взаимодействие соляной кислоты с оксидом железа (II) относится к реакции: а) разложения, б) замещения, в)
- 18. Дифференцированная самостоятельная работа по тестам 1-й уровень: 1-а; 2-в; 3-б; 4-г; 2-й уровень: 1-г; 2-г; 3-а;
- 20. Скачать презентацию















 Амины. Анилин
Амины. Анилин Полимеры (10 класс)
Полимеры (10 класс) Химический элемент цинк
Химический элемент цинк Кислород
Кислород Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Теория электролитической диссоциации
Теория электролитической диссоциации Азот. Строение атома и молекулы
Азот. Строение атома и молекулы Алкены. Непредельные углеводороды ряда этилена
Алкены. Непредельные углеводороды ряда этилена Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Карбоновые кислоты и их функциональные производные
Карбоновые кислоты и их функциональные производные Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Полимеры
Полимеры Кислотно-основное титрование. Алкалиметрия
Кислотно-основное титрование. Алкалиметрия Алюминий и его соединения
Алюминий и его соединения Сера и ее важнейшие соединения
Сера и ее важнейшие соединения Установка производства олефинов для синтеза линейных алкилбензолов
Установка производства олефинов для синтеза линейных алкилбензолов Алюминий и его соединения
Алюминий и его соединения Свойства неорганических веществ. (Задание 37. ЕГЭ по химии)
Свойства неорганических веществ. (Задание 37. ЕГЭ по химии) Основи. Загальна формула основ
Основи. Загальна формула основ Природный и попутный нефтяной газы
Природный и попутный нефтяной газы Гидрокси және оксоқышқылдар биологиялық рөлі
Гидрокси және оксоқышқылдар биологиялық рөлі Искусственные полимеры
Искусственные полимеры Протекание ОВР зависит от рН среды
Протекание ОВР зависит от рН среды Природный и попутный нефтяные газы
Природный и попутный нефтяные газы 20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii
20230330_metodicheskaya_razrabotka_ovr_v_organicheskoy_himii Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ