Слайд 2

План:
1. Общая характеристика комплексонометрического титрования.
2.Способы титрования.
3. Индикаторы.
4. Применение методов для
анализа ЛВ.
Слайд 3

1. Общая характеристика комплексонометрического титрования.
Коплекснометрическое титрование ( или комплексонометрия) основано на
образовании прочных комплексных соединений хелатного типа ионов металлов со специальными органическими реагентами группы аминополикарбоновых кислот- комплексонами. В практике химического и фармацевтического анализа наиболее часто применяют комплексон III (кислая динатриевая соль этилендиаминтетрауксусной кислоты, ЭДТА, торговое название – Трилон Б). Трилон Б хорошо растворим в воде, его молярная масса М(Трилон Б) = 372,25г. Для простоты в уравнениях реакции формулу Трилона Б часто изображают Nа2Н2Y
Слайд 4
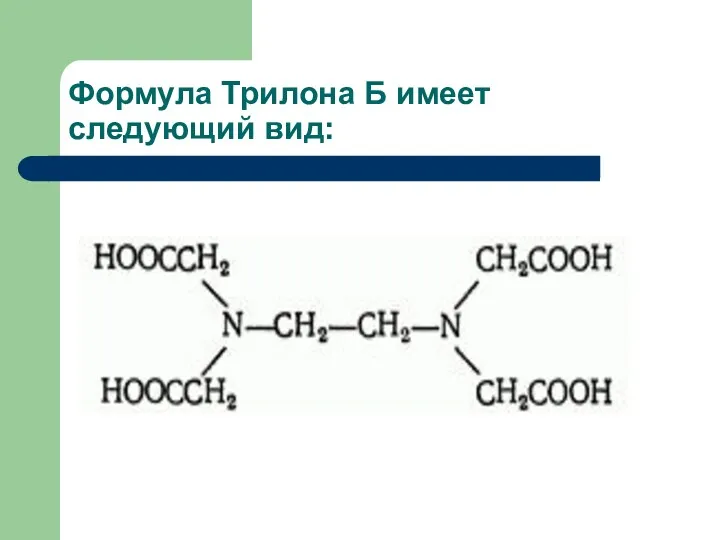
Формула Трилона Б имеет следующий вид:
Слайд 5
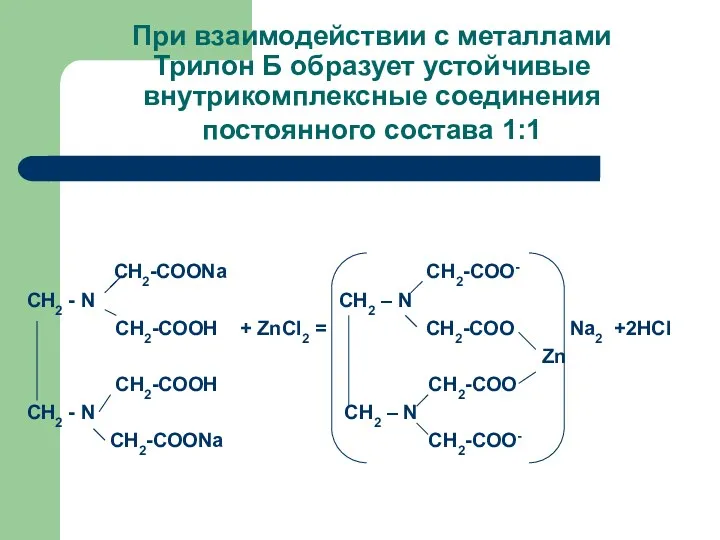
При взаимодействии с металлами
Трилон Б образует устойчивые внутрикомплексные соединения постоянного
состава 1:1
СН2-СООNа СН2-СОО-
СН2 - N СН2 – N
СН2-СООН + ZnСl2 = СН2-СОО Nа2 +2НСl
Zn
СН2-СООН СН2-СОО
СН2 - N СН2 – N
СН2-СООNа СН2-СОО-
Слайд 6
![Схематично это записывается так: Н2Y2- + Ме2+ ↔ [МеY]2- +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/329880/slide-5.jpg)
Схематично это записывается так:
Н2Y2- + Ме2+ ↔ [МеY]2- + 2Н+
или
Н2Y2-
+ Zn2+ ↔ [ZnY]2- + 2Н+
Выделяющиеся при реакции ионы водорода сдвигают равновесие реакции образования комплекса влево, поэтому для полноты протекания реакции титрование проводят в аммонийной буферной смеси при рН = 8-13.
Слайд 7

Методика определения массовой доли кальция хлорида в концентрированном растворе СаСl2 (1:5)
методом прямого титрования
При этом протекают следующие реакции, которые можно изобразить схематично:
1. Н2Ind + Са2+ = СаInd + 2Н+
2. Н+ + NН3 + Н2О ↔ NН4+ + Н2О
3. Са2+ + Н2Y2- = 2Н+ + СаY2-
4. СаInd- + Н2Y2- +ОН- = СаY2- + НInd2- + Н2О
Слайд 8

Точную концентрация Трилона Б устанавливают по стандартным растворам солей цинка, меди,
магния.
Слайд 9

Метод комплексонометрии обладает рядом преимуществ:
обладает высокой чувствительностью;
реакции протекают быстро и стехиометрично,
т.е. в строго эквивалентных соотношениях;
обладает высокой избирательностью.
Слайд 10

2.Способы титрования.
Комплексонометрическое титрование можно проводить методом прямого, обратного и вытеснительного титрования
Слайд 11

1. Метод прямого титрования реализуют при рН =8-13 стандартным раствором
Трилона
Б в присутствии аммиачной буферной смеси (NН4ОН + NН4СI), которая нейтрализует кислотность, выделяющихся ионов Н+.
Конечную точку титрования устанавливают с помощью индикаторов
Слайд 12

2. Метод обратного титрования используют, если для катиона металла невозможно подобрать
индикатор. К анализируемому раствору добавляют отмеренный объем стандартного раствора Трилона Б, избыток которого титруют стандартным раствором соли магния или цинка в присутствии металло-индикатора, реагирующего с ионами магния или цинка;
Слайд 13

3. Метод вытеснительного титрования – в анализируемый раствор вводят избыток трилона
Б в виде комплекса с магнием или цинком. Если катион определяемого металла образует с Трилоном Б более устойчивый комплекс, чем соответствующий комплекс с магнием или цинком, протекает реакция:
[ZnY]2- + Ме2+ = [МеY]2- +Zn2+ , выделившиеся ионы магния или цинка титруют затем стандартным раствором Трилона Б
Слайд 14

3. Индикаторы
Для титрования Трилоном Б используют металлоиндикаторы, они образуют с ионами
металла окрашенные комплексы. При титровании раствором Трилона Б комплексы разрушаются. Окраска комплекса МеInd отличается от окраски свободного индикатора НInd. В следствии этого, в процессе титрования индикатор выделяется в свободном виде, что вызывает изменение окраски титруемого раствора, особенно в конечной точке титрования.
Слайд 15

Схематично это можно изобразить так:
До титрования:
Ме2+ + Н2Ind
↔ МеInd + 2Н+ бесцветный синий красный
Во время титрования и конечной его точке:
МеInd + Н2Y2- ↔ Н2Ind + МеY2-
красный бесцветный синий бесцветный
Слайд 16

Примером таких индикаторов служат
Эриохром черный Т, кислотный хром-темно-синий. Эти индикаторы синего
цвета, способные в в нейтральной или щелочной среде (рН = 7-11) образовывать комплексы с ионами металлов – кальцием, цинком, марганцем, магнием, алюминием и др.
Цвет комплекса МеInd – красного цвета.
При титровании раствором Трилона Б окраска раствора из красной превращается в синюю в конечной точке титрования.
Слайд 17

Мурексид - окрашен в темно-красный цвет. Водный раствор окрашен в фиолетово-красный
цвет, изменяющийся в зависимости от среды раствора: при рН ≤ 9 в красно-фиолетовый цвет,
Рн =10 – фиолетовый,
рН ˃ 11 – сине-фиолетовый.
Слайд 18

4. Применение методов для анализа ЛВ
Комплексонометрическое титрование используется для определения многих
катионов. Большое значение при применение этого метода имеет регулирование рН.
Титрование в кислой среде можно использовать для определения катионов со степенью окисления 3+.
В щелочной среде титруются катионы со степенью окисления 2+.




![Схематично это записывается так: Н2Y2- + Ме2+ ↔ [МеY]2- +](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/329880/slide-5.jpg)












 Классификация, строение и номенклатура органически. Предмет органической химии
Классификация, строение и номенклатура органически. Предмет органической химии Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) Природные источники углеводородов
Природные источники углеводородов Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Александр Евгеньевич Ферсман
Александр Евгеньевич Ферсман Амины
Амины Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева
Характеристика химического элемента по его положению в периодической системе элементов Д.И.Менделеева Хлорид натрия (NaCI)
Хлорид натрия (NaCI) Производства аммиака. Лекция 7
Производства аммиака. Лекция 7 Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Рідкі кристали
Рідкі кристали Железо и его сплавы
Железо и его сплавы Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии The Sulphur cycle. The Sulphur dioxide problems
The Sulphur cycle. The Sulphur dioxide problems Спирти. Історична довідка
Спирти. Історична довідка Химия в решении сырьевой проблемы
Химия в решении сырьевой проблемы Аминокислоты. Белки
Аминокислоты. Белки Органическая химия в ряду других наук
Органическая химия в ряду других наук Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали Топливный элемент
Топливный элемент Химия и косметика
Химия и косметика Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Углепластики
Углепластики Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Будова електронних оболонок атомів
Будова електронних оболонок атомів Кристаллическое состояние вещества в природе
Кристаллическое состояние вещества в природе Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Метод МО
Метод МО