Содержание
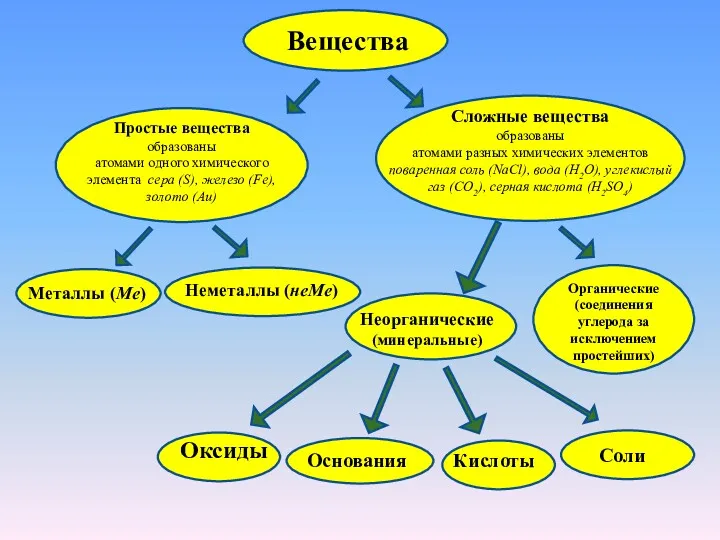
- 2. Вещества Простые вещества образованы атомами одного химического элемента сера (S), железо (Fe), золото (Au) Сложные вещества
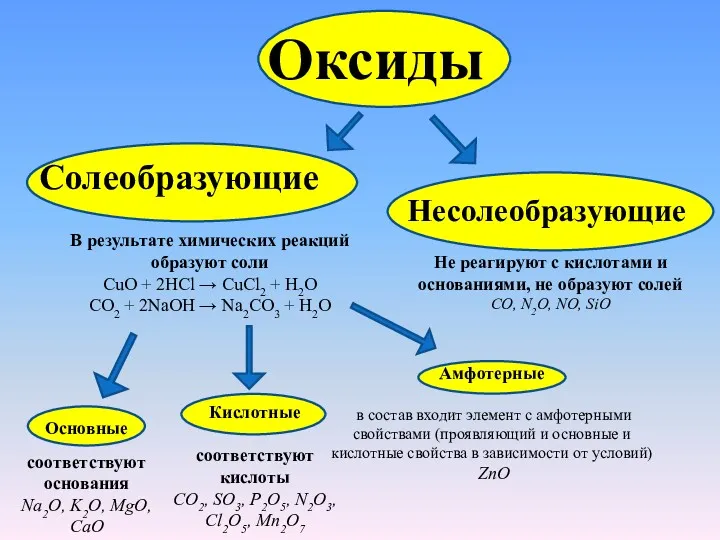
- 4. Оксиды Солеобразующие В результате химических реакций образуют соли CuO + 2HCl → CuCl2 + H2O CO2
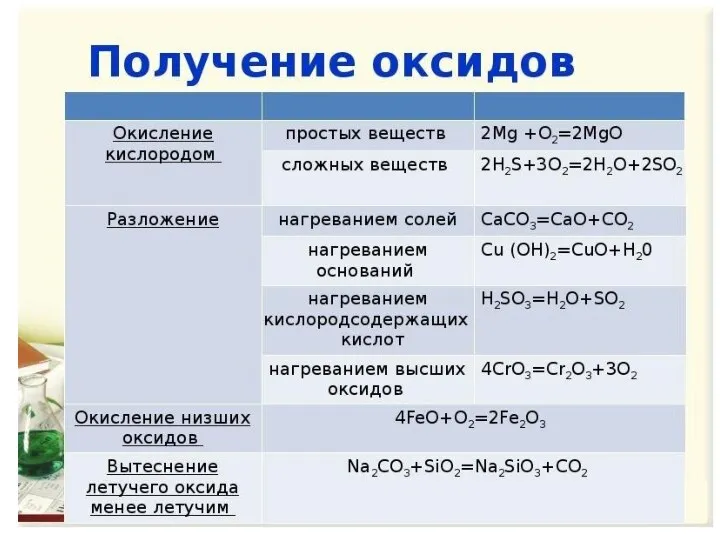
- 9. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ: Основные оксиды взаимодействуют с водой, образуя щёлочи, большинство кислотных оксидов при взаимодействии с
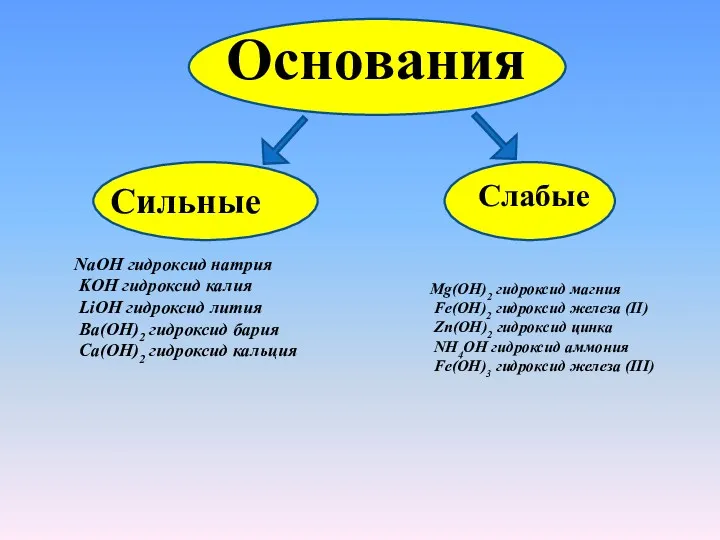
- 12. Основания Сильные NaOH гидроксид натрия KOH гидроксид калия LiOH гидроксид лития Ba(OH)2 гидроксид бария Ca(OH)2 гидроксид
- 13. Физические свойства оснований: Щёлочи - твёрдые белые кристаллические вещества (за исключением NH4OH - прозрачная жидкость), хорошо
- 14. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ: Реагируют с кислотами с образованием соли и воды: 2KOH + H2SO4 = K2SO4
- 15. Атомы водорода в кислоте способны замещаться на металл с образованием солей Zn + 2HCl → ZnCl₂
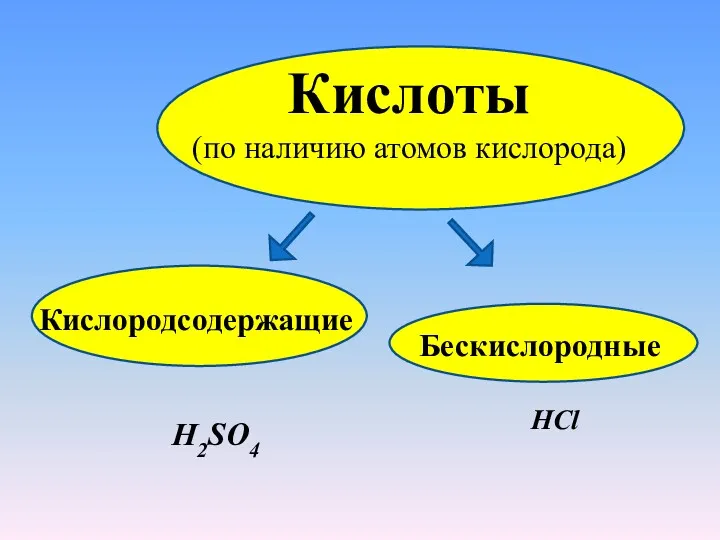
- 16. Кислоты (по наличию атомов кислорода) Кислородсодержащие H2SO4 Бескислородные HCl
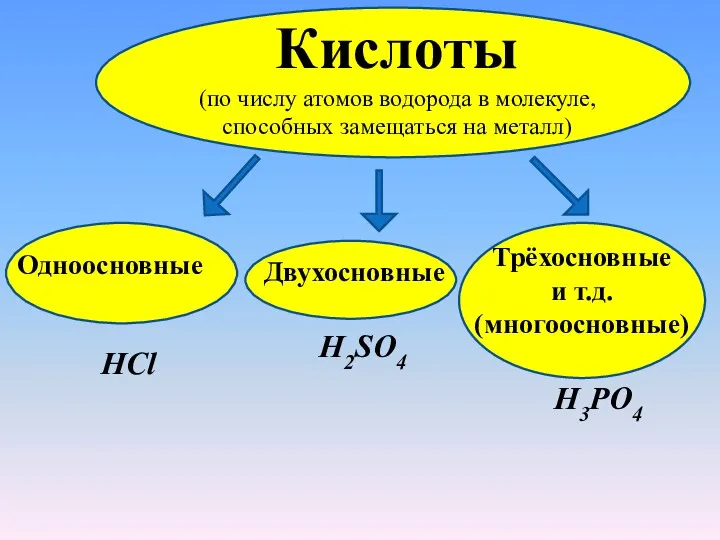
- 17. Кислоты (по числу атомов водорода в молекуле, способных замещаться на металл) Одноосновные HCl Трёхосновные и т.д.
- 22. ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ: Взаимодействуют с металлами, стоящими в электрохимическом ряду напряжений до водорода: Ca + H2SO4(р-р)
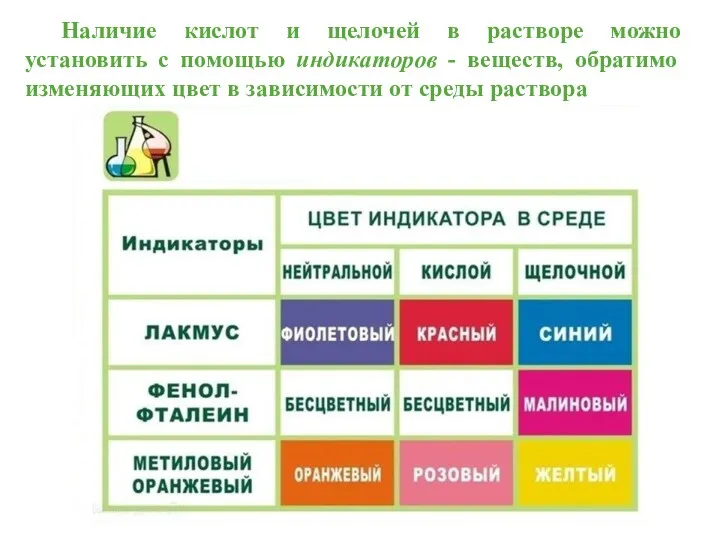
- 23. Наличие кислот и щелочей в растворе можно установить с помощью индикаторов - веществ, обратимо изменяющих цвет
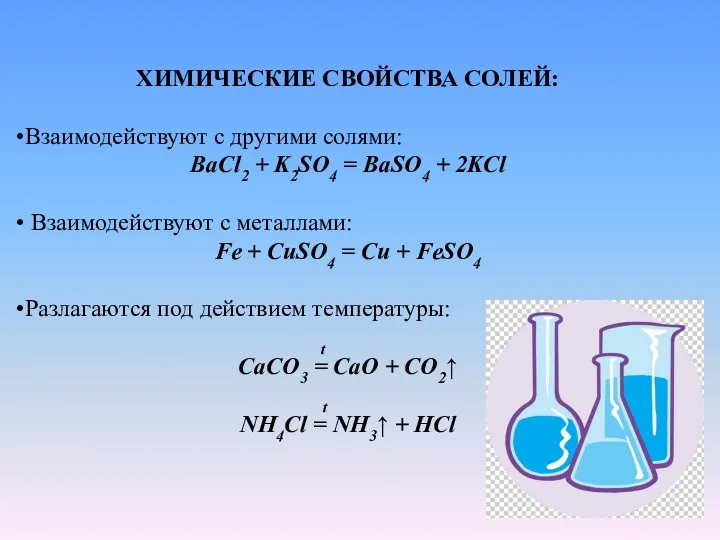
- 28. ХИМИЧЕСКИЕ СВОЙСТВА СОЛЕЙ: Взаимодействуют с другими солями: BaCl2 + K2SO4 = BaSO4 + 2KCl Взаимодействуют с
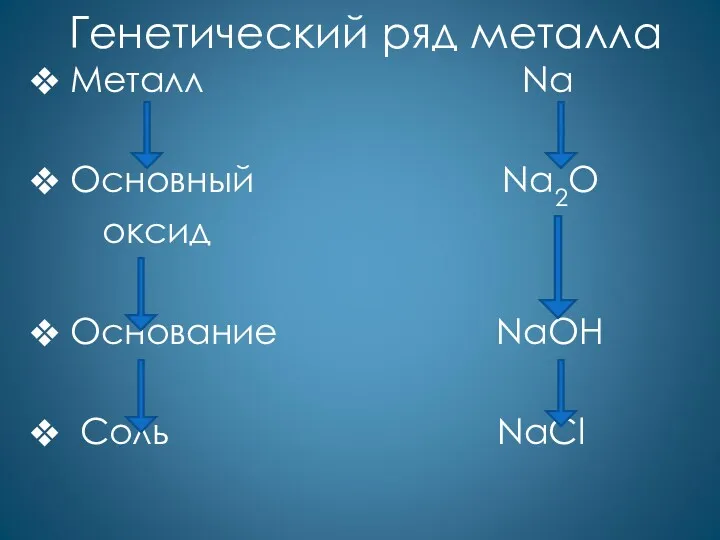
- 30. Генетический ряд металла Металл Na Основный Na2O оксид Основание NaOH Соль NaCl
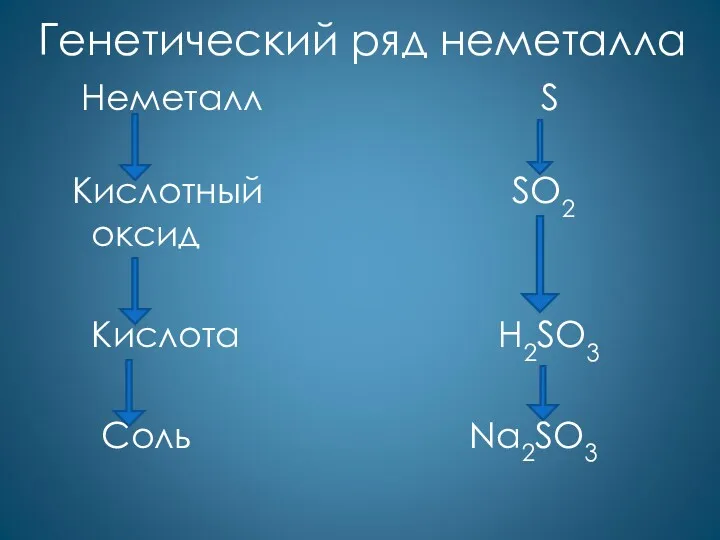
- 31. Генетический ряд неметалла Неметалл S Кислотный SO2 оксид Кислота H2SO3 Соль Na2SO3
- 33. Скачать презентацию

















 Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Форми періодичної системи хімічних елементів
Форми періодичної системи хімічних елементів Хром и его соединения
Хром и его соединения Цветные сплавы
Цветные сплавы Боевые отравляющие вещества
Боевые отравляющие вещества Влияние алкоголя на организм подростка. Химический состав алкоголя
Влияние алкоголя на организм подростка. Химический состав алкоголя Предельные углеводороды и их производные
Предельные углеводороды и их производные Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот
Кислоты. Состав и классификация кислот. Формулы и названия основных неорганических кислот Химический тренажер. Химические элементы
Химический тренажер. Химические элементы Теория растворов. Диффузия в растворах. Коллигативные свойства растворов
Теория растворов. Диффузия в растворах. Коллигативные свойства растворов Alkaline earth metals
Alkaline earth metals Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Термодинамика. 1 закон термодинамики
Термодинамика. 1 закон термодинамики НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Общая характеристика неметаллов
Общая характеристика неметаллов Figure
Figure Химический состав прямогонных бензинов
Химический состав прямогонных бензинов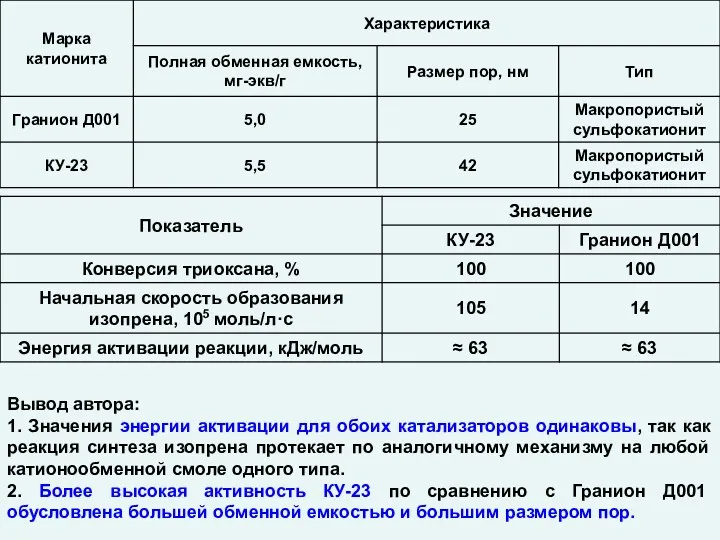 Катализ. Гетерогенные катализаторы
Катализ. Гетерогенные катализаторы Химический элемент алюминий
Химический элемент алюминий Коллоидные ПАВ
Коллоидные ПАВ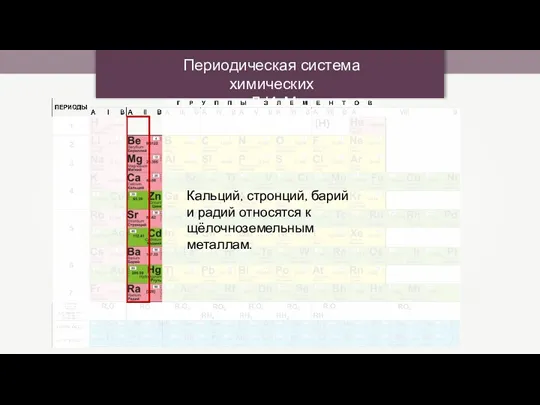 Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Кевлар. Структура кевлара
Кевлар. Структура кевлара Благородные металлы
Благородные металлы Получение наночастиц в сверхкритическом флюиде
Получение наночастиц в сверхкритическом флюиде Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Технология выращивания кристаллов методом Чохральского
Технология выращивания кристаллов методом Чохральского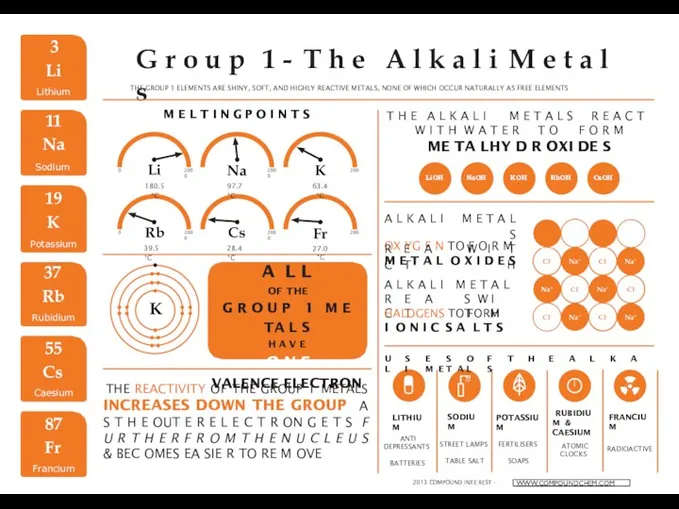 The alkali metals
The alkali metals