Содержание
- 2. ПЛАН СЕМИНАРА Положение хрома в ПСХЭ Получение и свойства Cr0 Получение и свойства оксида и гидроксида
- 3. КЛЮЧЕВЫЕ ВОПРОСЫ ЗАНЯТИЯ 1. Как изменяются кислотно-основные свойства соединений хрома? 2. Как изменяются окислительно-восстановительные свойства соединений
- 4. ХРОМ Химический элемент побочной подгруппы VI группы периодической системы Менделеева Атомный номер 24, Атомная масса 51,996;
- 5. ПОЛОЖЕНИЕ ХРОМА В ПСХЭ При составлении электронной формулы хрома необходимо вспомнить, что в связи с большей
- 6. ФИЗИЧЕСКИЕ СВОЙСТВА. Хром – белый блестящий металл, очень твердый, хрупкий, тугоплавкий. Устойчив к коррозии. На воздухе
- 7. ХИМИЧЕСКИЕ СВОЙСТВА. ВЗАИМОДЕЙСТВИЕ С ПРОСТЫМИ ВЕЩЕСТВАМИ. При обычных условиях хром реагирует только со фтором. При высоких
- 8. ВЗАИМОДЕЙСТВИЕ СО СЛОЖНЫМИ ВЕЩЕСТВАМИ. В раскалённом состоянии реагирует с парами воды: 2Cr + 3H2O =Cr2O3 +
- 9. ПОЛУЧЕНИЕ. Электролизом водных растворов или расплавов его солей:
- 10. Алюминотермия: Cr2O3 + 2Al = Al2O3 + 2Cr Восстановлением оксидов хрома, оксидом углерода (II), водородом: CrO
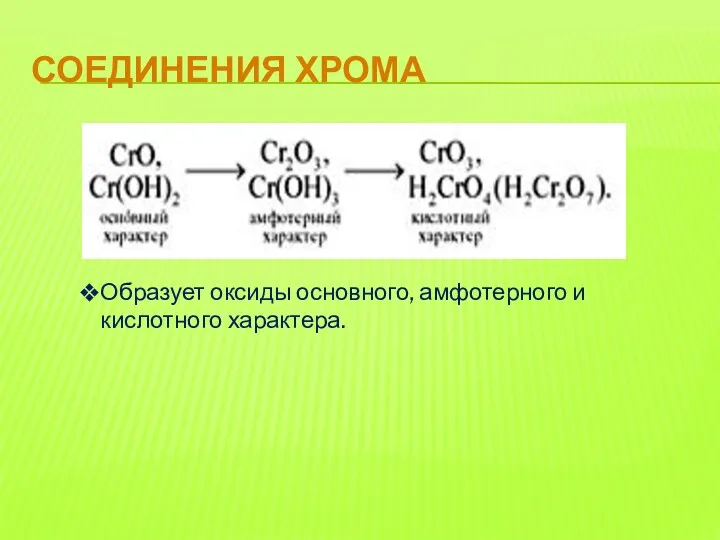
- 11. СОЕДИНЕНИЯ ХРОМА Образует оксиды основного, амфотерного и кислотного характера.
- 12. СОЕДИНЕНИЯ ДВУХВАЛЕНТНОГО ХРОМА ОКСИД ХРОМА (II) CrO – основной оксид, восстановитель 1) Взаимодействует с кислотами: CrO
- 13. Получение. 1) При окислении амальгамы хрома на воздухе: 2Cr + O2= 2 CrO 2) При прокаливании
- 14. ГИДРОКСИД ХРОМА (II) Физические свойства: твердое нерастворимое в воде вещество желтого цвета. Химические свойства. Сr(ОН)2 –
- 15. СОЕДИНЕНИЯ ТРЁХВАЛЕНТНОГО ХРОМА ОКСИД ХРОМА (III) Физические свойства: темно-зеленое тугоплавкое вещество, нерастворимое в воде. Химические свойства.
- 16. Получение. 1) При окислении хрома: 4Cr + 3O2 = 2Cr2O3 2) При разложении гидроксида хрома (III):
- 17. ГИДРОКСИД ХРОМА (III) Физические свойства: нерастворимое в воде вещество зелёного цвета. Химические свойства. Сr(ОН)3 – амфотерный
- 18. Получение. 1) При действии щелочей на соли Сr3+ выпадает студнеобразный осадок гидроксида хрома (III) зеленого цвета:
- 19. СОЕДИНЕНИЯ ШЕСТИВАЛЕНТНОГО ХРОМА ОКСИД ХРОМА (VI) Физические свойства: твердое вещество темно-красного цвета, хорошо растворимое в воде.
- 20. ГИДРОКСИДЫ ХРОМА (VI) - ХРОМОВАЯ КИСЛОТА, ДИХРОМОВАЯ КИСЛОТА Обе кислоты неустойчивы, при попытке их выделения в
- 21. K2Cr2+6O7 + 7H2SO4 (разб) + 6KI = Cr2+3(SO4)3 + 4K2SO4 + 3I20 + 7H2O Cr+6 +
- 22. КАЧЕСТВЕННЫЕ РЕАКЦИИ НА ХРОМАТ-ИОН И ДИХРОМАТ-ИОН Налейте в пробирку немного раствора хромата калия и прилейте раствор
- 23. ИСТОРИЯ ОТКРЫТИЯ В 1797 г. французский химик Л. Вокелен впервые исследовал красноватый, тяжелый минерал крокоизит, из
- 24. БИОЛОГИЧЕСКАЯ РОЛЬ Хром обнаруживается в растительных и животных организмах. В организме взрослого человека содержится примерно 6
- 25. Хром — один из биогенных элементов, постоянно входит в состав тканей растений и животных. У животных
- 26. ПИЩЕВЫЕ ИСТОЧНИКИ ХРОМА пшеничные ростки, печень, мясо, сыр, бобы, горох, цельное зерно, черный перец, мелисса, пивные
- 27. НАХОЖДЕНИЕ В ПРИРОДЕ В природе хром находится в трехвалентном (шпинель - двойной оксид МnСrO4 -- магнохромит)
- 28. ПРИМЕНЕНИЕ МЕТАЛЛИЧЕСКОГО ХРОМА В виде феррохрома сплавляют с железом и получают высококачественные твердые при высокой температуре
- 29. НАГЛЯДНОЕ ПРИМЕНЕНИЕ ХРОМА
- 31. Скачать презентацию



























 Чистые вещества и смеси
Чистые вещества и смеси Мыло и синтетические моющие средства
Мыло и синтетические моющие средства Материаловедение. Лекция 1
Материаловедение. Лекция 1 Залізо. Фізичні та хімічні властивості
Залізо. Фізичні та хімічні властивості Почему мыло пенится
Почему мыло пенится Алюминий
Алюминий Гидрогеохимия урана и тория
Гидрогеохимия урана и тория Природные источники углеводородов
Природные источники углеводородов Химические волокна (7 класс)
Химические волокна (7 класс) Аргентум, или серебро
Аргентум, или серебро Алкины. Физические и химические свойства
Алкины. Физические и химические свойства Спирты: общая характеристика
Спирты: общая характеристика Бескислородные керамические материалы
Бескислородные керамические материалы Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Objectives and background. Apply for an unknown mixture
Objectives and background. Apply for an unknown mixture Процессы, проходящие в растворах (продолжение темы)
Процессы, проходящие в растворах (продолжение темы) The Molecules of Life
The Molecules of Life Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья
Зеленая химия полиуретанов: механизм, катализ, проблемы использования возобновляемого сырья Электродные процессы
Электродные процессы Физические и химические свойства алмаза. Алмазная промышленность в России
Физические и химические свойства алмаза. Алмазная промышленность в России Кислоты
Кислоты Вклад ученых-химиков в победу в Великой Отечественной войне
Вклад ученых-химиков в победу в Великой Отечественной войне Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Основні класи неорганічних сполук
Основні класи неорганічних сполук Совершенствование урока химии в условиях ФГОС
Совершенствование урока химии в условиях ФГОС Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Химическая кинетика и катализ
Химическая кинетика и катализ Органічні сполуки. 3D моделі органічних сполук
Органічні сполуки. 3D моделі органічних сполук