Содержание
- 2. Что такое сложные эфиры и жиры? R1, R2, R3-углеводородные радикалы (для сложных эфиров) и углеводородные радикалы
- 3. Номенклатура Названия сложных эфиров производят от названия углеводородного радикала и названия кислоты, в котором вместо окончания
- 4. Изомерия Изомерия углеродной цепи начинается по кислотному остатку с бутановой кислоты, по спиртовому остатку — с
- 5. 2. Изомерия положения сложноэфирной группировки —СО—О— Этот вид изомерии начинается со сложных эфиров, в молекулах которых
- 6. 3. Межклассовая изомерия -например, метилацетату изомерна пропановая кислота. СН3―СО―О―СН3 метилацетат С2Н5―СО―ОН пропионовая кислота Изомерия
- 7. 4. Для сложных эфиров, содержащих непредельную кислоту или непредельный спирт, возможны еще два вида изомерии: изомерия
- 8. Физические свойства сложных эфиров Сложные эфиры низших карбоновых кислот и спиртов представляют собой летучие, нерастворимые в
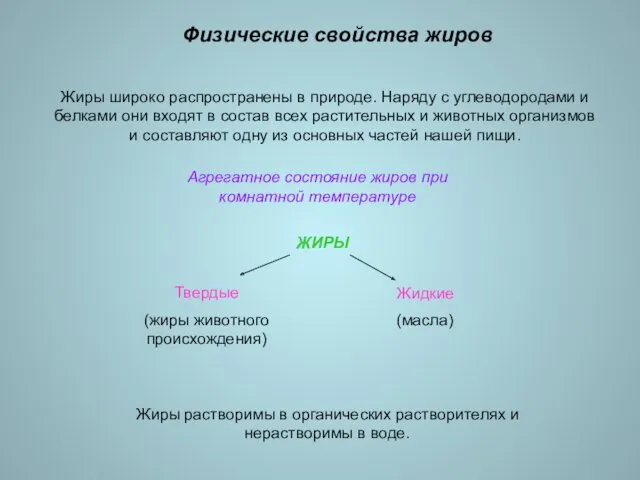
- 9. Физические свойства жиров Жиры широко распространены в природе. Наряду с углеводородами и белками они входят в
- 10. Химические свойства сложных эфиров Процесс расщепления сложного эфира при действии воды с образованием карбоновой кислоты и
- 11. Химические свойства сложных эфиров Реакция присоединения. Сложные эфиры, имеющие в своем составе непредельную кислоту или спирт,
- 12. Одно из важнейших свойств жиров ― их способность расщепляться на составляющие: глицерин и карбоновые кислоты. Если
- 13. Химические свойства жиров Если на выделяющуюся карбоновую кислоту действовать щелочью ― она превратится в соль: C17H35COOH
- 14. Химические свойства жиров Твердые животные жиры более ценны и дорогостоящи, чем растительные масла. Способ превращения непредельных
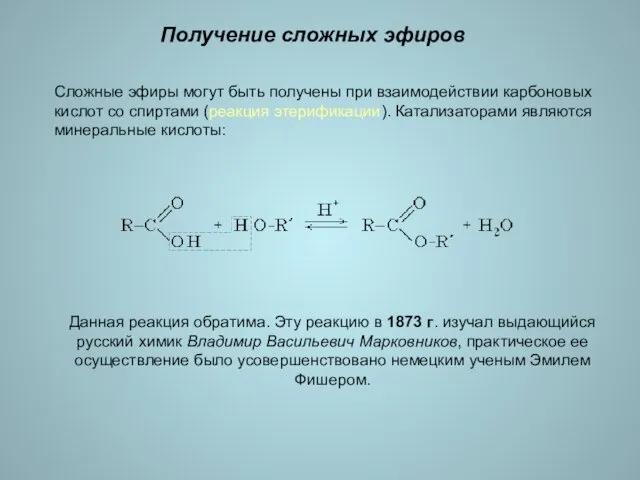
- 15. Получение сложных эфиров
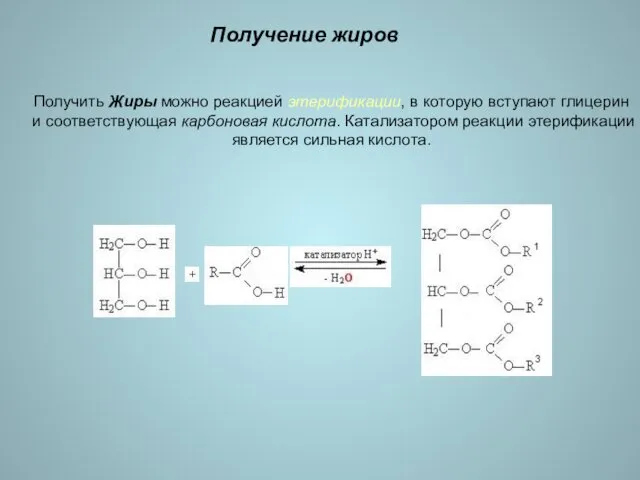
- 16. Получение жиров Получить Жиры можно реакцией этерификации, в которую вступают глицерин и соответствующая карбоновая кислота. Катализатором
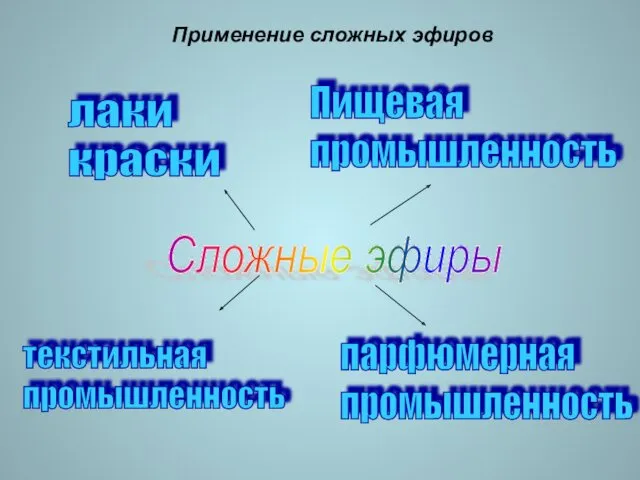
- 17. Применение сложных эфиров лаки краски Пищевая промышленность парфюмерная промышленность Сложные эфиры текстильная промышленность
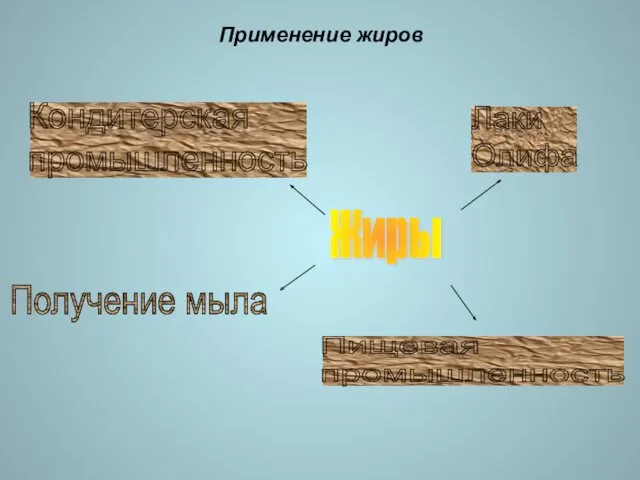
- 18. Применение жиров Жиры Лаки Олифа Кондитерская промышленность Получение мыла Пищевая промышленность
- 19. Интересное о жирах Жиры являются одной из трех главных составляющих пищи человека и животных , наряду
- 21. Скачать презентацию













 Кислоты, их состав и названия
Кислоты, их состав и названия Обмен липидов
Обмен липидов Роль воды в химических реакциях
Роль воды в химических реакциях Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары
Органикалық қосылыстардың химиялық құрылыс теориясы, органикалық қосылыстардың структурасы және қосылыстары Непредельные углеводороды. Этилен и его гомологи
Непредельные углеводороды. Этилен и его гомологи Процессы в растворах: электролитическая диссоциация (ЭД)
Процессы в растворах: электролитическая диссоциация (ЭД) IV группа главная подгруппа
IV группа главная подгруппа Хімічні явища в побуті. 7 клас
Хімічні явища в побуті. 7 клас Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток Углерод и его соединения
Углерод и его соединения Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени
Химическая кинетика. Часть II. Скорость химической реакции - развитие реакции во времени Неметаллические материалы
Неметаллические материалы Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро
Кількість речовини. Моль - одиниця кількості речовини. Число Авогадро Производство полимеров
Производство полимеров Основания. Неорганические соединения
Основания. Неорганические соединения Полиэтилен — термопластичный полимер этилена
Полиэтилен — термопластичный полимер этилена Кислотно-основное титрование
Кислотно-основное титрование Состояние радионуклидов в различных фазах и методы его изучения
Состояние радионуклидов в различных фазах и методы его изучения Поверхностные явления. Адсорбция
Поверхностные явления. Адсорбция Обучение в сотрудничестве на уроках химии
Обучение в сотрудничестве на уроках химии Ароматические азотсодержащие соединения
Ароматические азотсодержащие соединения Основания, их классификация и свойства в свете теории электролитической диссоциации
Основания, их классификация и свойства в свете теории электролитической диссоциации Кристаллы. Выращивание кристалла
Кристаллы. Выращивание кристалла Строение и свойства аминокислот и белков
Строение и свойства аминокислот и белков Автомобильные пластичные смазки
Автомобильные пластичные смазки Игра Химические элементы (формулы и названия)
Игра Химические элементы (формулы и названия) Окислительновосстановительное титрование
Окислительновосстановительное титрование