Содержание
- 2. План 1. Протолитическая теория кислот и оснований. Типы протолитов. 2. Протолитические равновесия в воде, шкала рН.
- 3. Электронная теория Г. Н. Льюиса (1926 г.).
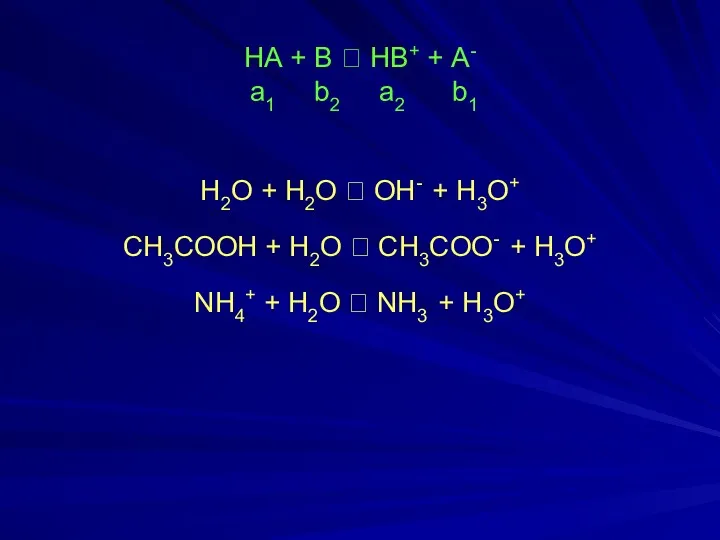
- 4. Протолитическая теория кислот и оснований (ПТКО) Бренстеда-Лоури НА ⮀ Н+ + А- а1 b1 В +
- 5. НА + В ⮀ НВ+ + А- а1 b2 а2 b1 H2O + H2O ⮀ OH-
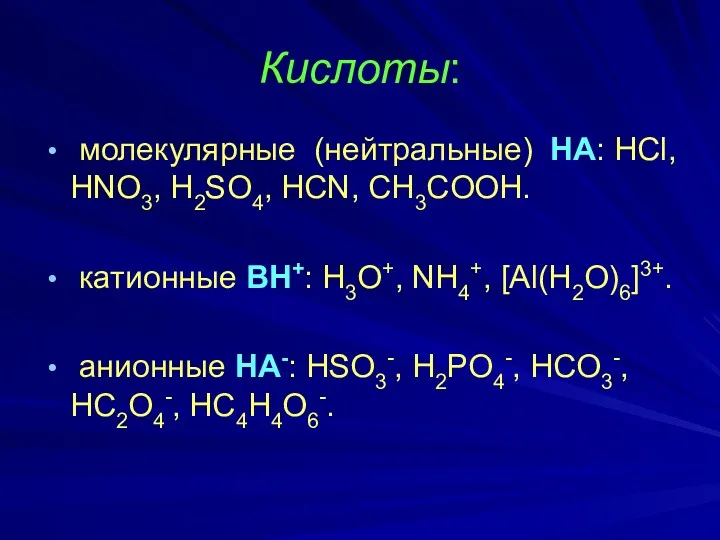
- 6. Кислоты: молекулярные (нейтральные) НА: HCl, HNO3, H2SO4, HCN, CH3COOH. катионные ВН+: H3O+, NH4+, [Al(H2O)6]3+. анионные НА-:
- 7. Основания: молекулярные (нейтральные) В: NH3, CH3-NH2, C6H5N, NaOH, H2N-NH2. катионные В+: H2N-NH3+, [Zn(OH)(H2O)3]+. анионные А-: Сl-,
- 8. Амфолиты: анионные кислоты, они же анионные основания НА-: HSO3-, H2PO4-, HCO3-, HC2O4-, HC4H4O6-.
- 9. Амфолиты: нейтральные молекулы В: [Zn(OH)2(H2O)2], [Al(OH)3(H2O)3], [Cr(OH)3(H2O)3].
- 10. Амфолиты: катионные основания, они же катионные кислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+, [Al(OH)2(H2O)4]+, [Cr(OH)2(H2O)4]+.
- 11. Протолитические равновесия в воде H2O + H2O ⮀ OH- + H3O+ H2О ⮀ H+ + OH-
- 12. Протолитические равновесия в воде КС∙[Н2О] = КН2О = Кw = 1,86∙10-16 ∙55,56 =10-14 КН2О = Кw
- 13. Протолитические равновесия в воде рКw = - lg Kw = -lg 10-14 = 14 [H3O+] =
- 14. Шкала рН
- 15. [H3O+] = 10-рН [OH-] = 10-рОН При 100°С (Кw = 55∙10-14) чистая вода имеет рН =
- 16. HA + H2О ⮀ H3O+ + A-
- 17. B + H2O ⮀ BH+ + OH-
- 18. закон разбавления (законом разведения) Оствальда: При α
- 19. рKа = –lg Kа; pKb = –lg Kb Кw = Ка ∙ Кb или рКw =
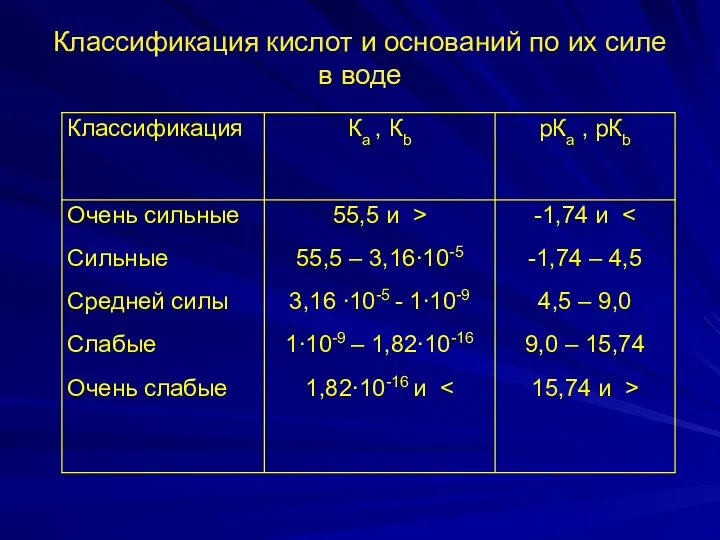
- 20. Классификация кислот и оснований по их силе в воде
- 21. Автопротолиз CH3СООН + CH3СООН ⮀ CH3COO- + CH3COOH2+ NH3 + NH3 ⮀ NH2- + NH4+ CH3ОН
- 22. Поскольку [НSolv] = const, то КС∙[НSolv] = const = Ks Ks = [H2Solv+]∙[Solv-] рКs = рH2Solv
- 23. Степень сольволиза
- 24. Кислотные: CH3COOH + CH3COONa (pH = 3,8 – 6,3) HCl + H2N-CH2-COOH (pH =1,1 – 3,5)
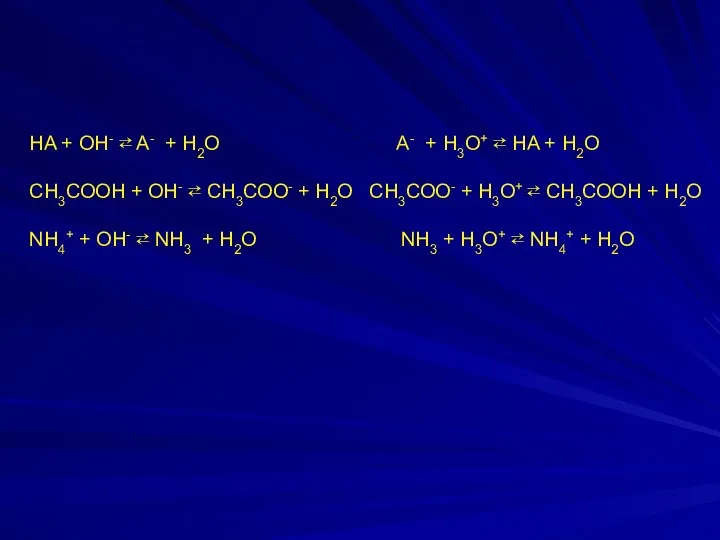
- 25. HA + ОH- ⇄ A- + H2O A- + H3O+ ⇄ HA + H2О СН3СООН +
- 26. Буферная емкость
- 28. Кислотные свойства: Основные свойства:
- 29. Bi(OH)3 + H2O ⮀ H2BiO3- + H3O+ В сильно щелочной среде [H3O+] = 10-14 моль/л
- 31. Скачать презентацию





![Амфолиты: нейтральные молекулы В: [Zn(OH)2(H2O)2], [Al(OH)3(H2O)3], [Cr(OH)3(H2O)3].](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-8.jpg)
![Амфолиты: катионные основания, они же катионные кислоты В+: H2N-NH3+, [Zn(OH)(H2O)3]+, [Al(OH)2(H2O)4]+, [Cr(OH)2(H2O)4]+.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-9.jpg)

![Протолитические равновесия в воде КС∙[Н2О] = КН2О = Кw =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-11.jpg)


![[H3O+] = 10-рН [OH-] = 10-рОН При 100°С (Кw =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-14.jpg)

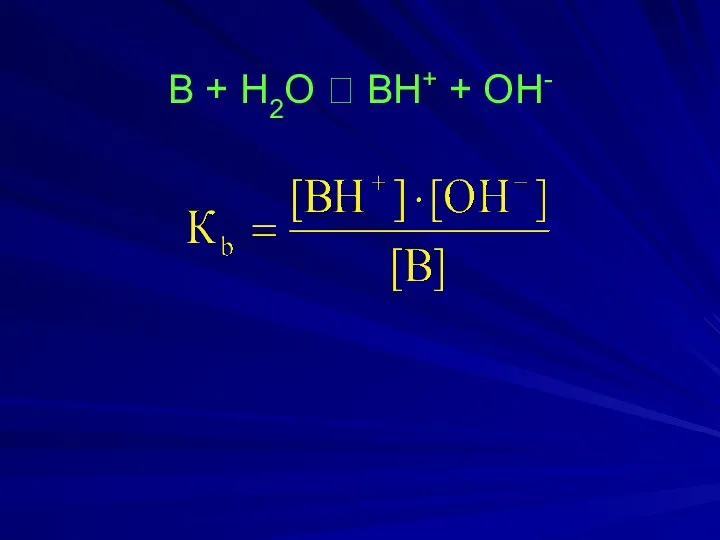



![Поскольку [НSolv] = const, то КС∙[НSolv] = const = Ks](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-21.jpg)



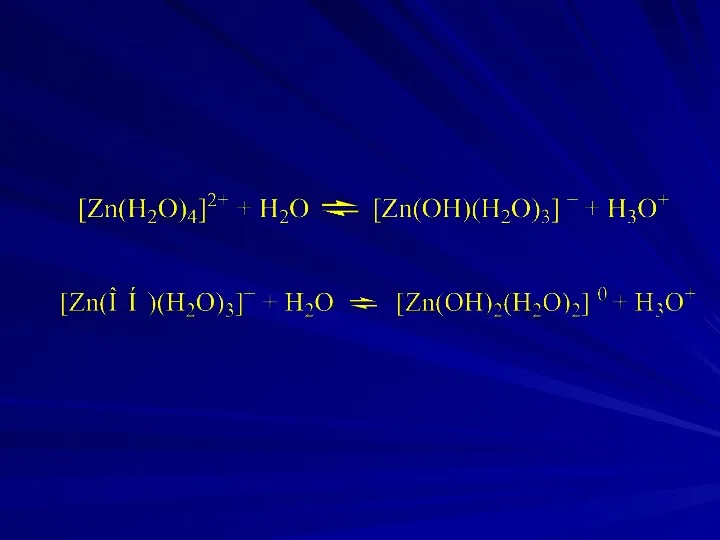

![Bi(OH)3 + H2O ⮀ H2BiO3- + H3O+ В сильно щелочной среде [H3O+] = 10-14 моль/л](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/269852/slide-28.jpg)
 Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Важнейшие реакции в органической химии
Важнейшие реакции в органической химии Лекция 6. Желтые пигменты
Лекция 6. Желтые пигменты Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна Електролітична дисоціація. Гідроліз солей
Електролітична дисоціація. Гідроліз солей Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ
Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием. Инструктаж по ТБ Зерттеу әдістері
Зерттеу әдістері Хлороводород..Соляная кислота
Хлороводород..Соляная кислота Фазовое равновесие
Фазовое равновесие Сероводород
Сероводород Франций (Francium)
Франций (Francium) Роль хімії у суспільстві
Роль хімії у суспільстві Кислородсодержащие органические вещества. Фенолы
Кислородсодержащие органические вещества. Фенолы Разнообразие неметаллов
Разнообразие неметаллов Минералогия с основами кристаллографии
Минералогия с основами кристаллографии Фізичні властивості та хімічний склад природних вод
Фізичні властивості та хімічний склад природних вод Припекание взаимно растворимых твердых тел
Припекание взаимно растворимых твердых тел Металл цирконий (ZR)
Металл цирконий (ZR) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Химия в повседневной жизни человека
Химия в повседневной жизни человека Alyuminiy_ego_soedinenia
Alyuminiy_ego_soedinenia Углерод. Общая характеристика элементов подгруппы углерода
Углерод. Общая характеристика элементов подгруппы углерода Физические и химические свойства алкенов
Физические и химические свойства алкенов Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019
Тип соли. Задачи к вопросу 34 по спецификации ЕГЭ-2019 Особенности органических веществ. Теория химического строения А.М.Бутлерова
Особенности органических веществ. Теория химического строения А.М.Бутлерова Химия нефти и газа
Химия нефти и газа Решение заданий по теме: Оксиды
Решение заданий по теме: Оксиды Кислоты, их классификация и свойства
Кислоты, их классификация и свойства