Содержание
- 2. Дать понятие об амфотерности, амфотерных оксидах и гидроксидах, переходных металлах; Повторить, закрепить и развить знания о
- 3. Основные классы сложных веществ (повторение) Генетическая связь (повторение) Лабораторная работа Понятие амфотерности. Амфотерные оксиды и гидроксиды
- 4. Основные классы сложных веществ: Вещества Кислоты Основания Оксиды Соли
- 5. Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых – кислород со
- 6. Задание 1 Выберите из списка веществ оксиды: H2O, CO2, P2O5, WO3 Fe2O3 SO3, CaCl2, SCl6, CuO,
- 8. Основания – это сложные вещества, состоящие из ионов металлов и связанных с ними одного или нескольких
- 9. Щелочи образованы металлами I группы гл. подгруппы, II группы главной подгруппы (кроме Be) NaOH – гидроксид
- 10. Кислоты – это сложные вещества, молекулы которых состоят из атомов водорода и кислотных остатков. Кислородосодержащие кислоты:
- 11. Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков Соли KNO3 NaCl CuSO4
- 12. Распределите вещества по классам
- 13. Задание 2 Распределите вещества по классам: H2S, SO3, CuSO4, FeCl3, KOH, Na2O, Al(OH)3, K3PO4, FeS, Al2(SO4)3,
- 14. Проверьте себя:
- 15. М Основание нм Кислота (кислородосодержащая) Генетическая связь Основный оксид Кислотный оксид Соль
- 16. CaO Ca(OH)2 P2O5 H3PO4 P Ca Генетическая связь Ca3(PO)4
- 17. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки
- 18. Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со
- 19. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
- 20. Гидроксид – вещество, где есть гидроксогруппа -ОН O HNO3 H – O - N O H2SO4
- 21. Гидроксид алюминия можно записать как основание и как кислоту Al(OH)3 = H3AlO3 AlO3H3 = = Кислота
- 22. Al(OH)3 + 3HCl = AlCl3 +3H2O H3AlO3 + 3NaOH = Na3AlO3+3H2O Хлорид алюминия Алюминат натрия Запишите
- 23. Al2O3 + 6HCl = 2AlCl3 + 3H2O Al2O3 + 3NaOH = Na3AlO3 + 3H2O Как основный
- 24. Амфотерные Оксиды металлов (с.о. +2,+3,+4)
- 25. Амфотерные гидроксиды
- 26. Какие из групп веществ проявляют амфотерные свойства? Ca(ОН)2, Cu(ОН)2, NaОН, Fe(OН)2 Fe2O3, Al2O3, Fe(OН)3 , ZnO,
- 27. Допишите уравнение реакции: Zn(OH)2 + 2NaOH в результате образуются Na2ZnO2 + 2H2O Zn(OH)2 + Na2O ZnSO4
- 28. Совершенно верно!!!
- 29. Подумай ещё немного!
- 31. Скачать презентацию
 Теория электролитической диссоциации
Теория электролитической диссоциации Кислоты
Кислоты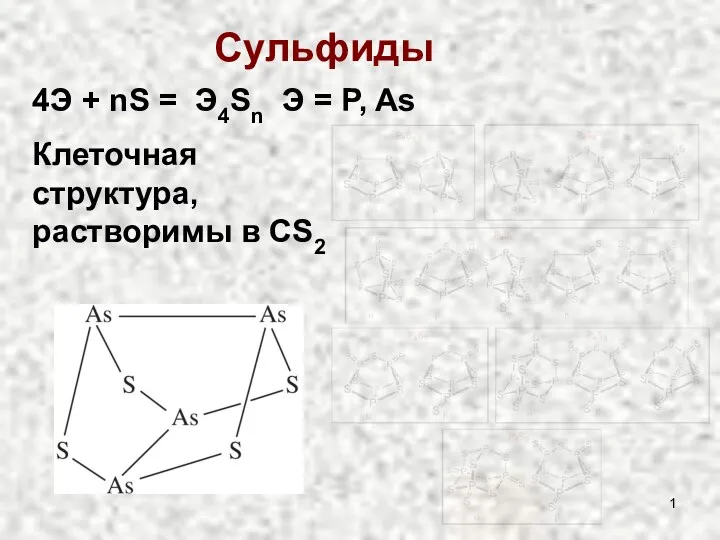 Сульфиды и оксиды
Сульфиды и оксиды Формы минералов и их агрегатов
Формы минералов и их агрегатов Азотная кислота
Азотная кислота Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов
Оксиды. Классификация. Номенклатура. Физические свойства оксидов. Химические свойства оксидов. Получение и применение оксидов Химические свойства неорганических соединений. Лабораторная работа
Химические свойства неорганических соединений. Лабораторная работа Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Химические явления. Горение. 5 класс
Химические явления. Горение. 5 класс Дифузія в побуті
Дифузія в побуті Неон (Ne)
Неон (Ne) Поверхностно-активные вещества (ПАВ)
Поверхностно-активные вещества (ПАВ) Сероводород. Сульфиды
Сероводород. Сульфиды Титан
Титан Производные фенантренизохинолина
Производные фенантренизохинолина Классы неорганических веществ
Классы неорганических веществ Гетероциклические соединения
Гетероциклические соединения Адсорбция
Адсорбция Химия в строительстве
Химия в строительстве Рафинирование от растворимых окислов
Рафинирование от растворимых окислов Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат
Лекарственные средства из группы карбоновых кислот и их производных калия ацетат, кальция лактат, натрия цитрат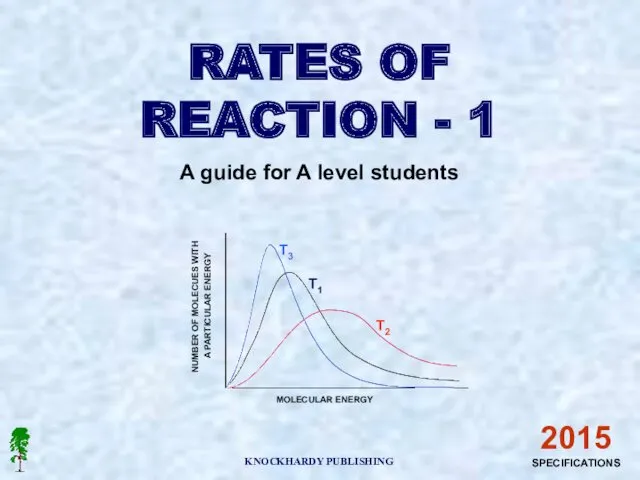 Number of molecues with a particular energy
Number of molecues with a particular energy Кислоты, их состав и названия
Кислоты, их состав и названия Природний газ
Природний газ Алотропні модифікації фосфору
Алотропні модифікації фосфору Галогены. Хлор
Галогены. Хлор Периодический закон и строение атома
Периодический закон и строение атома Кафедра химической технологии лекарственных веществ (ХТЛВ)
Кафедра химической технологии лекарственных веществ (ХТЛВ)