Содержание
- 2. ЦЕЛЬ: Изучить: Понятие о непредельных углеводородах. Характеристику тройной связи. Изомерию и номенклатуру алкинов. Физические свойства. Получение
- 3. ПОНЯТИЕ ОБ АЛКИНАХ Алкины – углеводороды, содержащие в молекуле одну тройную связь между атомами углерода, а
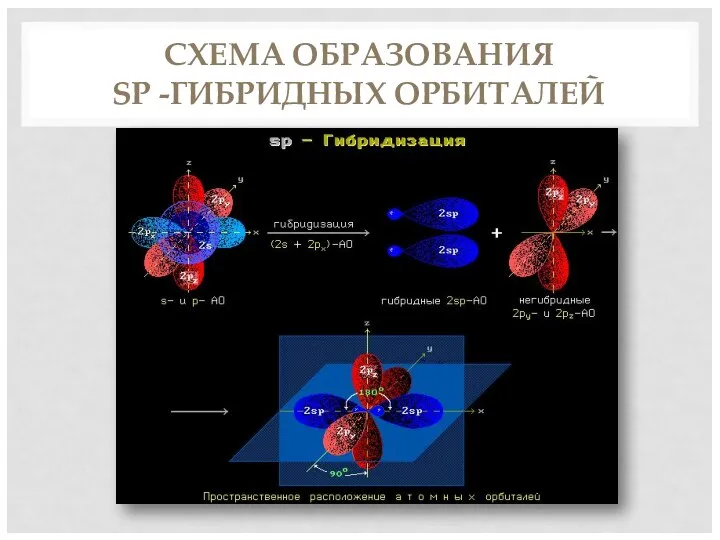
- 4. ХАРАКТЕРИСТИКА ТРОЙНОЙ СВЯЗИ Вид гибридизации – sp Валентный угол – 180 Длина связи С = С
- 5. СХЕМА ОБРАЗОВАНИЯ SP -ГИБРИДНЫХ ОРБИТАЛЕЙ
- 6. ГОМОЛОГИЧЕСКИЙ РЯД АЛКИНОВ C2H2 C3H4 C4H6 C5H8 C6H10 C7H12 Этин Пропин Бутин Пентин Гексин Гептин Что
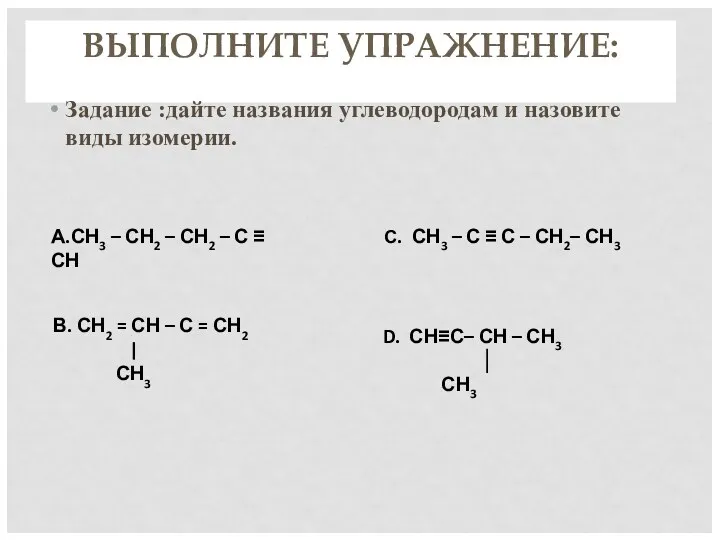
- 7. ВЫПОЛНИТЕ УПРАЖНЕНИЕ: Задание «Третий лишний». Докажите, что выбранный вами «лишний» углеводород отличается от других: 1. С4Н6
- 8. Изомерия алкинов Структурная изомерия 1. Изомерия положения тройной связи (начиная с С4Н6): СН ≡С−СН2−СН3 СН3−С≡С−СН3 бутин-1
- 9. А.СН3 – СН2 – СН2 – С ≡ СН С. СН3 – С ≡ С –
- 10. ФИЗИЧЕСКИЕ СВОЙСТВА 1. Температуры кипения и плавления алкинов, так же как и алкенов, закономерно повышаются при
- 11. Ацетилен получают в промышленности двумя способами: 1. Термический крекинг метана: 2. Гидролиз карбида кальция: CaC2 +
- 12. ХИМИЧЕСКИЕ СВОЙСТВА АЛКИНОВ Химические свойства ацетилена и его гомологов в основном определяются наличием в их молекулах
- 13. РЕАКЦИИ ПРИСОЕДИНЕНИЯ 1. Галогенирование Обесцвечивание бромной воды является качественной реакцией на все непредельные углеводороды 2. Гидрогалогенирование.
- 14. ОКИСЛЕНИЕ Ацетилен и его гомологи окисляются перманганатом калия с расщеплением тройной связи и образованием карбоновых кислот:
- 15. ГОРЕНИЕ АЦЕТИЛЕНА При сгорании (полном окислении) ацетилена выделяется большое количества тепла: HC≡CH + 2О2 ⎯→ 2СО2
- 16. РЕАКЦИИ ЗАМЕЩЕНИЯ При взаимодействии ацетилена (или R−C≡C−H) с аммиачными растворами оксида серебра выпадают осадки нерастворимых ацетиленидов:
- 17. РЕАКЦИЯ ПОЛИМЕРИЗАЦИИ Димеризация под действием водного раствора CuCl и NH4Cl: НC≡CH + НC≡CH ⎯→ Н2C=CH−C≡CH (винилацетилен)
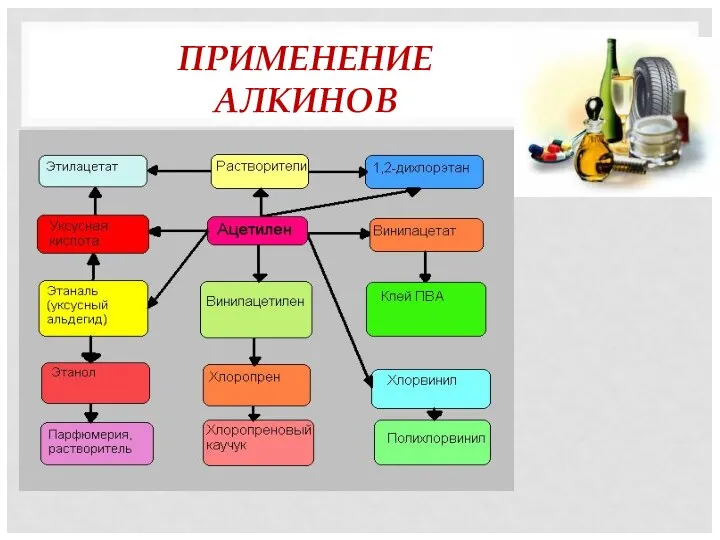
- 18. ПРИМЕНЕНИЕ АЛКИНОВ
- 20. Скачать презентацию














 Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури
Получение лиофобных коллоидных растворов методом пептизации на примере золя берлинской лазури Реакции деструкции макромолекул
Реакции деструкции макромолекул Морфология тел полезных ископаемых
Морфология тел полезных ископаемых Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева
Галогены - химические элементы 17-й группы периодической таблицы химических элементов Д.И. Менделеева Формирование системы знаний о веществе. Лекция 14-15
Формирование системы знаний о веществе. Лекция 14-15 Соли. Классификация. Физические и химические свойства. Получение и применение солей
Соли. Классификация. Физические и химические свойства. Получение и применение солей Неметаллические и композиционные материалы
Неметаллические и композиционные материалы Ненасыщенные углеводороды. Алкены
Ненасыщенные углеводороды. Алкены Многоядерные ароматические углеводороды
Многоядерные ароматические углеводороды 20190430_otkrytyy_urok_kislotypptx
20190430_otkrytyy_urok_kislotypptx Ендотермічні реакції на службі людини
Ендотермічні реакції на службі людини Ионное произведение воды. Водородный показатель воды
Ионное произведение воды. Водородный показатель воды Виды присадок к моторным топливам
Виды присадок к моторным топливам Кислородсодержащие соединения серы
Кислородсодержащие соединения серы Алюминий и его соединения
Алюминий и его соединения Фосфор и его соединения. 9 класс
Фосфор и его соединения. 9 класс Строение атома. Классификация ядер атомов
Строение атома. Классификация ядер атомов Колоїдний захист
Колоїдний захист Решение задач. Способы выражения состава раствора
Решение задач. Способы выражения состава раствора Свойства, получение и применение алканов. Циклоалканы
Свойства, получение и применение алканов. Циклоалканы Электрохимическая коррозия
Электрохимическая коррозия Проект Кабинет химии будущего
Проект Кабинет химии будущего Процессы алкилирования
Процессы алкилирования Белоктар. Биохимиясы
Белоктар. Биохимиясы ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА
ОСНОВАНИЯ, ИХ КЛАССИФИКАЦИЯ И СВОЙСТВА Учение об агрегатных состояниях вещества. Газообразное состояние
Учение об агрегатных состояниях вещества. Газообразное состояние Роль хімії у розв`язанні екологічної проблеми
Роль хімії у розв`язанні екологічної проблеми