Содержание
- 2. Алкены (олефины, этиленовые углеводороды) СnH2n Алкены— ациклические ненасыщенные углеводороды, содержащие одну двойную связь С=С Атомы углерода
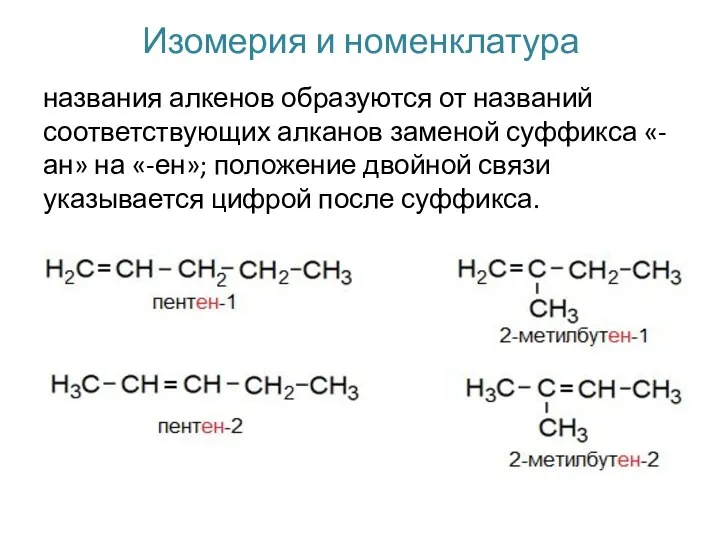
- 3. Изомерия и номенклатура названия алкенов образуются от названий соответствующих алканов заменой суффикса «-ан» на «-ен»; положение
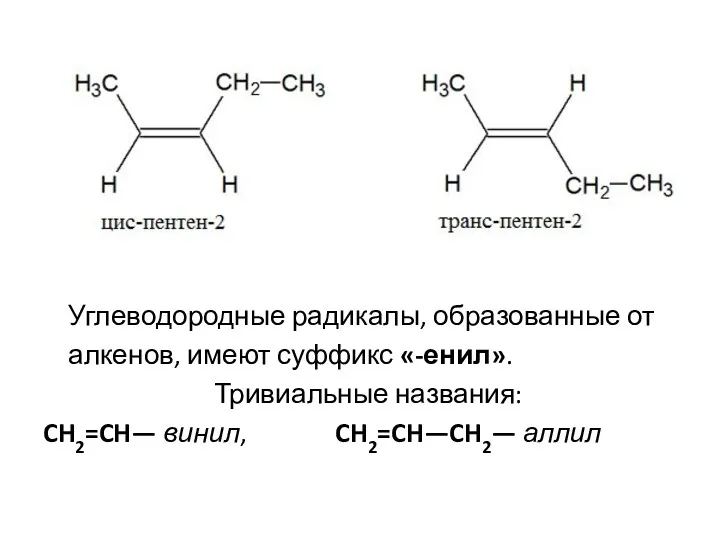
- 4. Углеводородные радикалы, образованные от алкенов, имеют суффикс «-енил». Тривиальные названия: CH2=CH— винил, CH2=CH—CH2— аллил
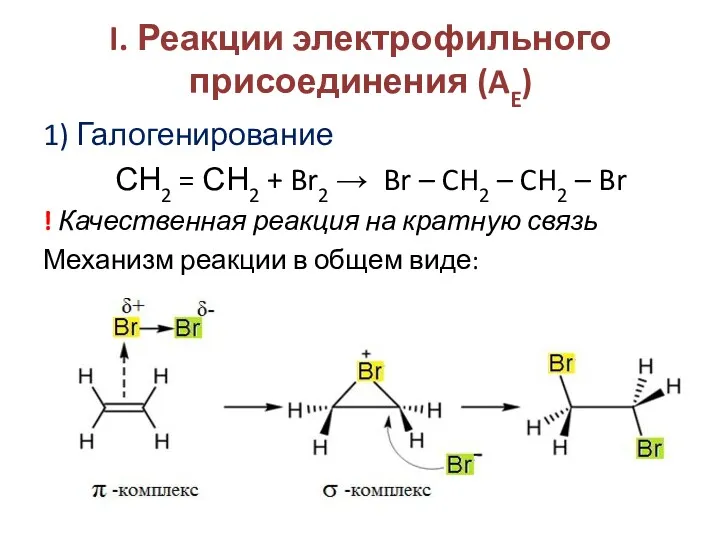
- 5. I. Реакции электрофильного присоединения (AE) 1) Галогенирование СН2 = СН2 + Br2 → Br – CH2
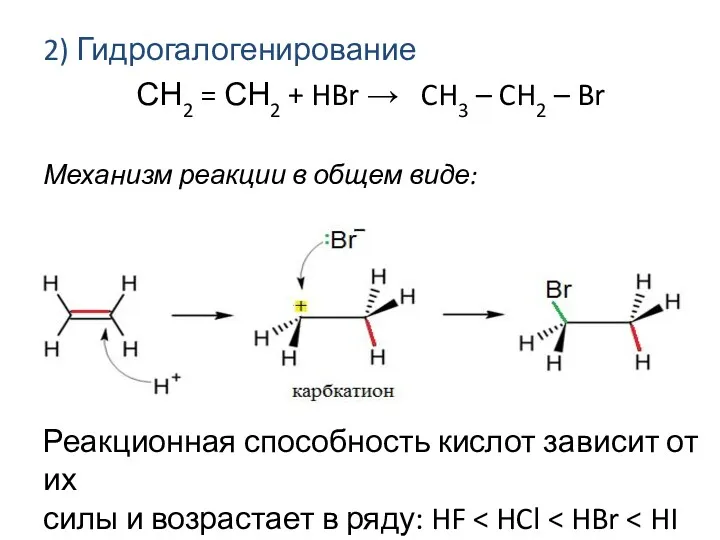
- 6. 2) Гидрогалогенирование СН2 = СН2 + HBr → CH3 – CH2 – Br Механизм реакции в
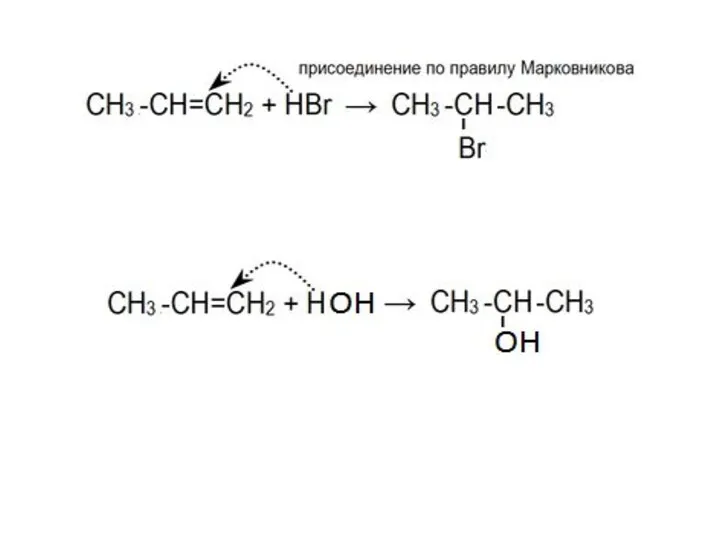
- 7. стабильность карбкатионов возрастает в ряду: Электрофильное присоединение галогеноводородов или воды к алкенам происходит по правилу Марковникова:
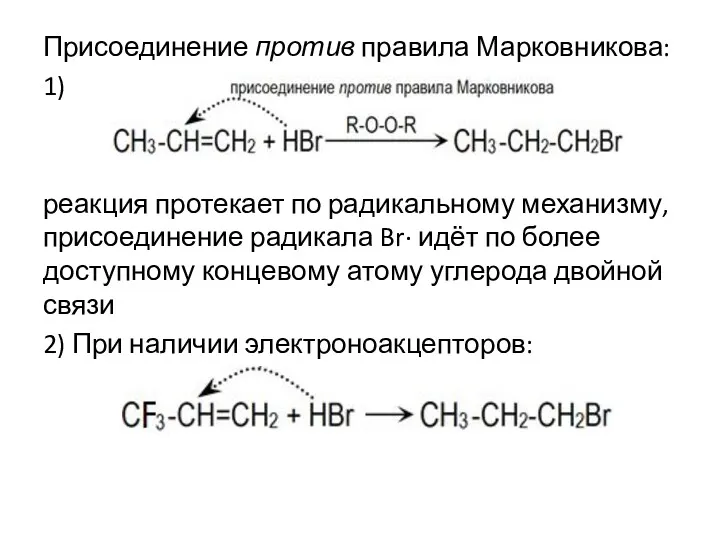
- 9. Присоединение против правила Марковникова: 1) реакция протекает по радикальному механизму, присоединение радикала Br· идёт по более
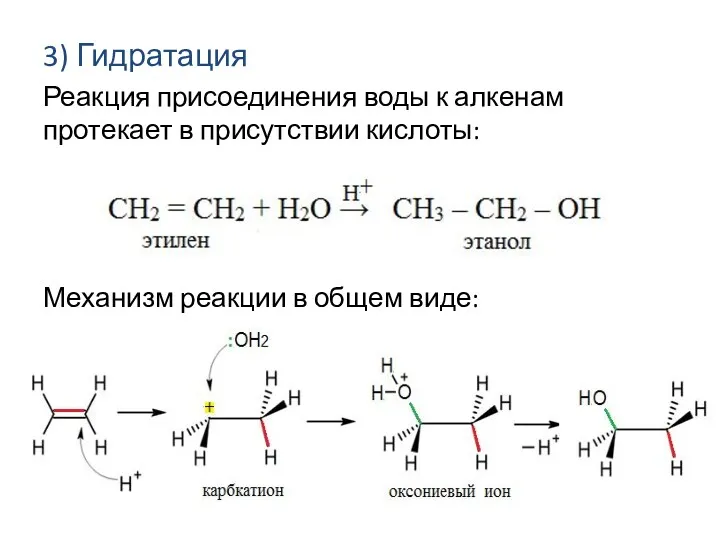
- 10. 3) Гидратация Реакция присоединения воды к алкенам протекает в присутствии кислоты: Механизм реакции в общем виде:
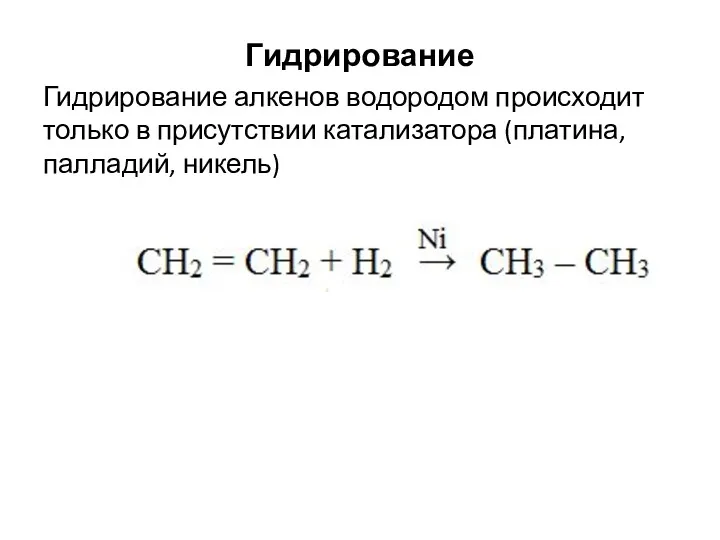
- 11. Гидрирование Гидрирование алкенов водородом происходит только в присутствии катализатора (платина, палладий, никель)
- 12. II. Реакции радикального замещения (SR) При высоких температурах (более 400 °C) происходит замещение атома водорода, находящегося
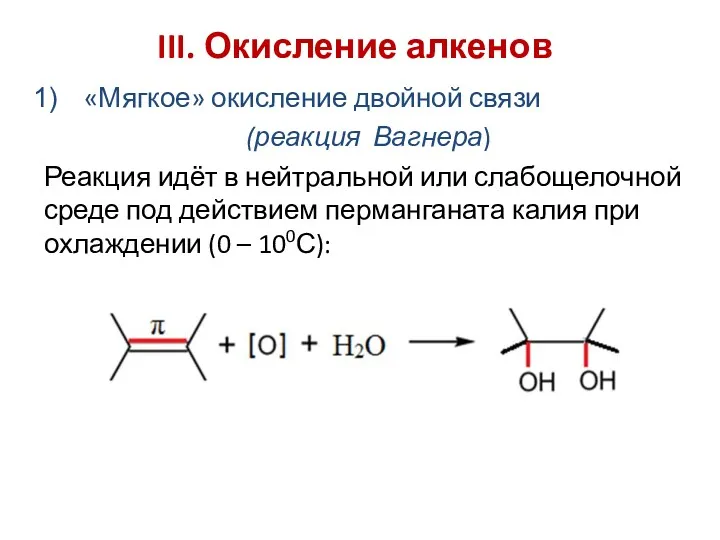
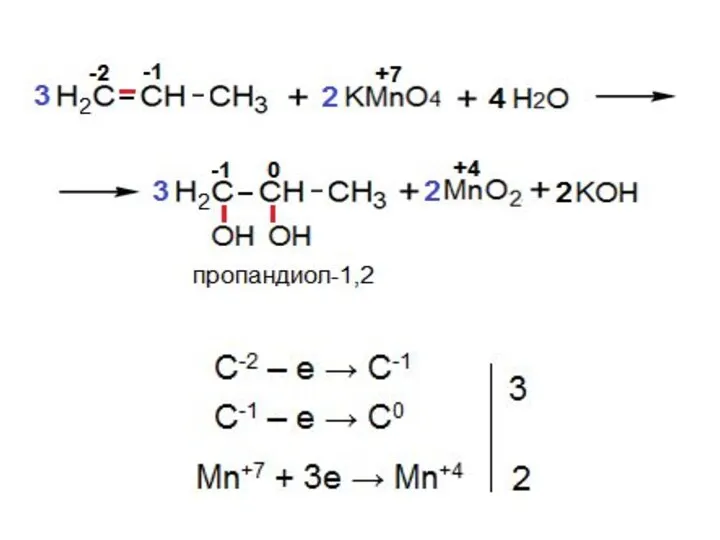
- 13. III. Окисление алкенов «Мягкое» окисление двойной связи (реакция Вагнера) Реакция идёт в нейтральной или слабощелочной среде
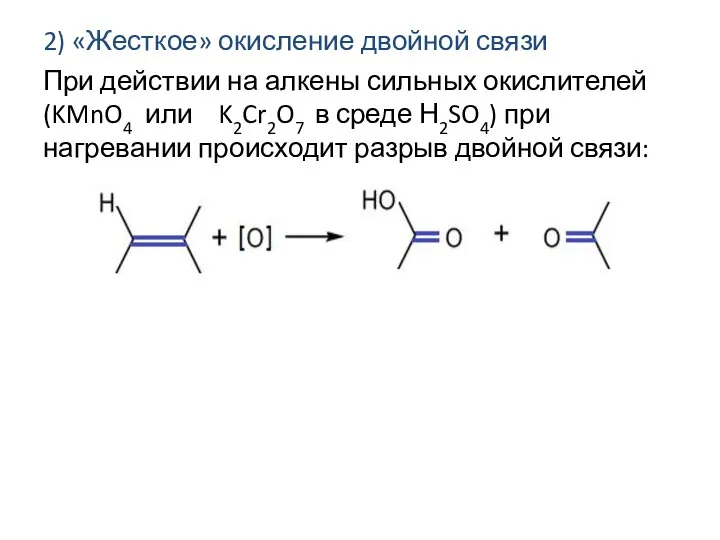
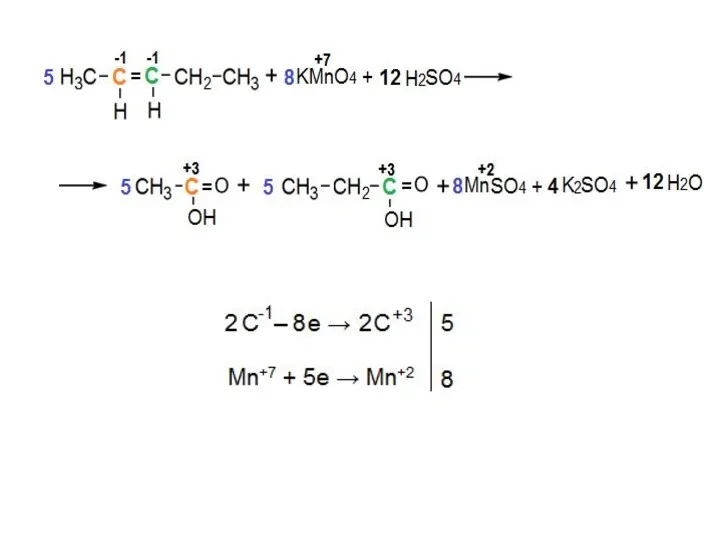
- 15. 2) «Жесткое» окисление двойной связи При действии на алкены сильных окислителей (KMnO4 или K2Cr2O7 в среде
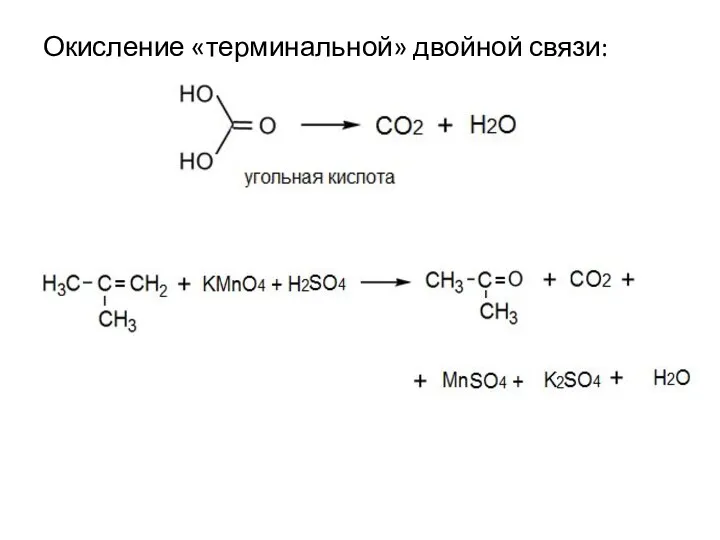
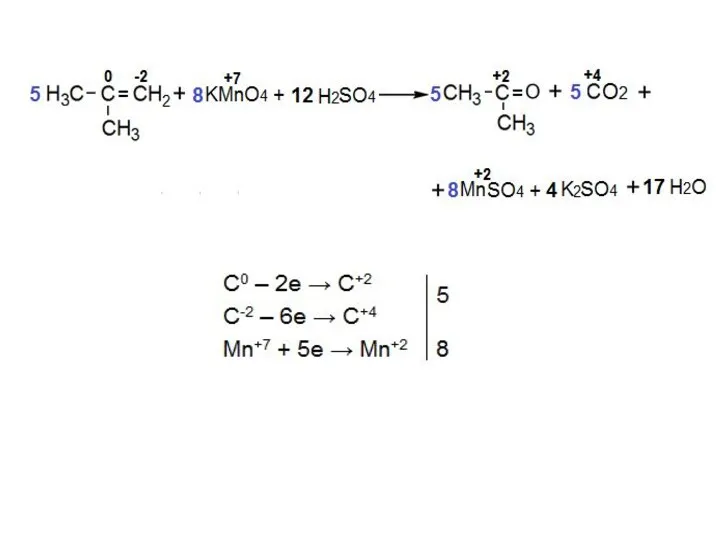
- 17. Окисление «терминальной» двойной связи:
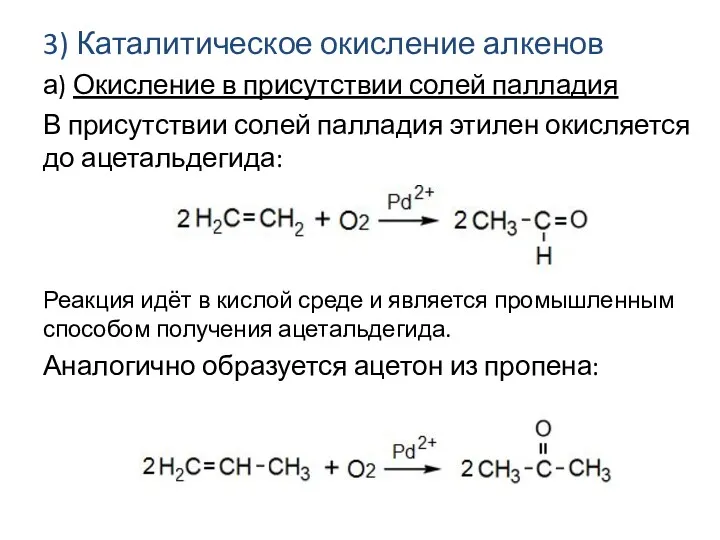
- 19. 3) Каталитическое окисление алкенов а) Окисление в присутствии солей палладия В присутствии солей палладия этилен окисляется
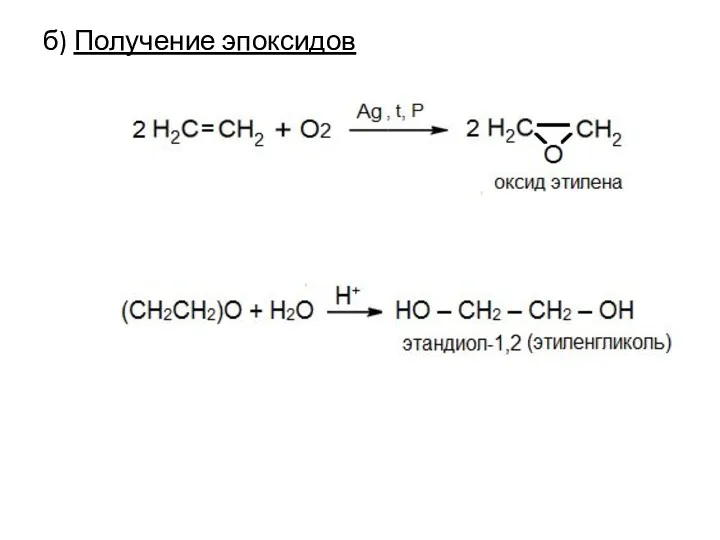
- 20. б) Получение эпоксидов
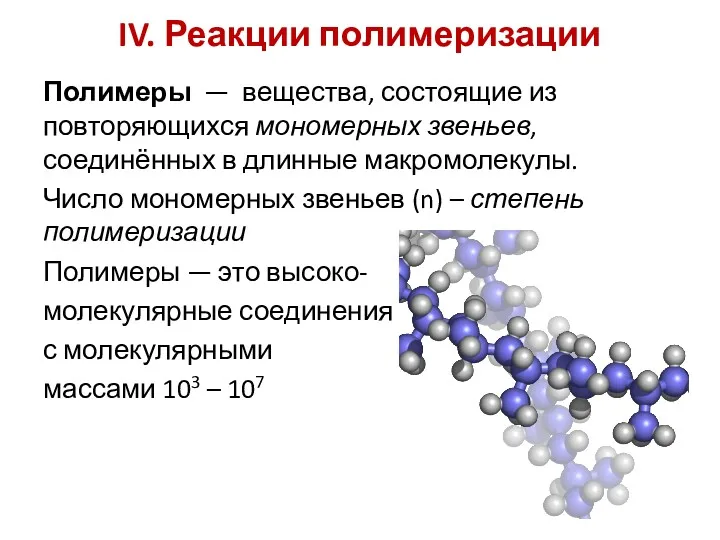
- 21. IV. Реакции полимеризации Полимеры — вещества, состоящие из повторяющихся мономерных звеньев, соединённых в длинные макромолекулы. Число
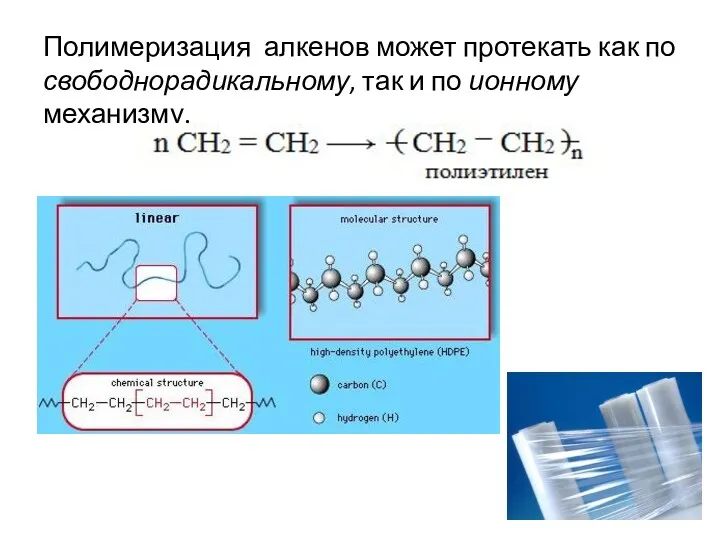
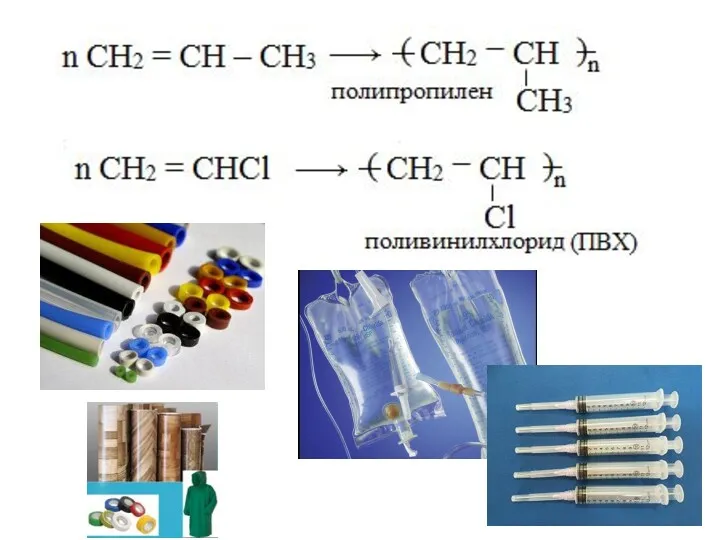
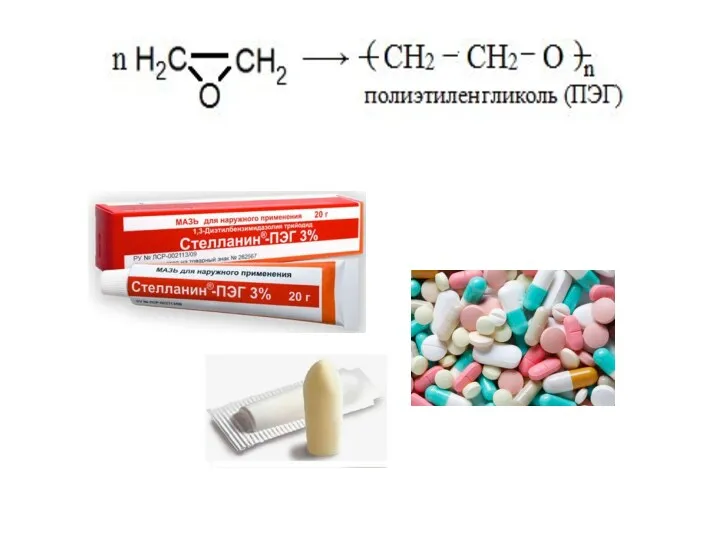
- 22. Полимеризация алкенов может протекать как по свободнорадикальному, так и по ионному механизму.
- 25. Получение алкенов Основным промышленным методом получения алкенов является каталитический и высокотемпературный крекинг углеводородов нефти. Для производства
- 26. 2) Дегидрогалогенирование галогеналканов Отщепление галогеноводородов проводят при нагревании действием спиртовыми растворами щелочей: правило Зайцева: Отщепление водорода
- 28. Скачать презентацию





 Иондар және олардың түзілуі
Иондар және олардың түзілуі Амины
Амины Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Біологічна хімія з основами фізичної і колоїдної хімії
Біологічна хімія з основами фізичної і колоїдної хімії Білки та амінокислоти
Білки та амінокислоти Роль хімії у суспільстві
Роль хімії у суспільстві Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров
Общая схема радиолиза алифатических углеводородов. Радиолиз органических кислот. Радиолиз кетонов эфиров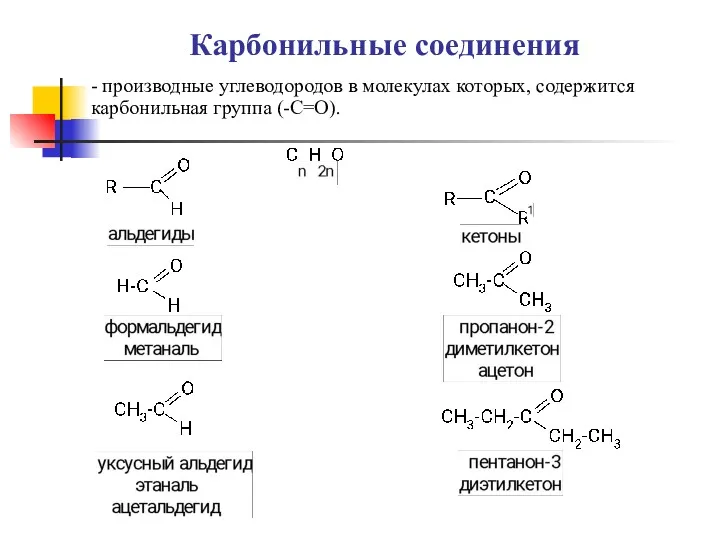 Карбоновые кислоты, альдегиды
Карбоновые кислоты, альдегиды Оксиды. Номенклатура, классификация, физические свойства
Оксиды. Номенклатура, классификация, физические свойства Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1 Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы”
Формирование ключевых и предметных компетенций учащихся при изучении темы “Металлы” Метаболизм нуклеотидов
Метаболизм нуклеотидов Серная кислота и её свойства. 9 класс
Серная кислота и её свойства. 9 класс Галогены. Химические свойства. Применение
Галогены. Химические свойства. Применение Пластмасса, пластикалық материалдар
Пластмасса, пластикалық материалдар Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі
Електролітична дисоціація. Електроліти та неелектроліти. Урок хімії в 9 класі Сахар - вред или польза?
Сахар - вред или польза? Lesson 2 and 3. The chemistry of life
Lesson 2 and 3. The chemistry of life Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Соли как производные кислот и оснований
Соли как производные кислот и оснований Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Фазовые диаграммы
Фазовые диаграммы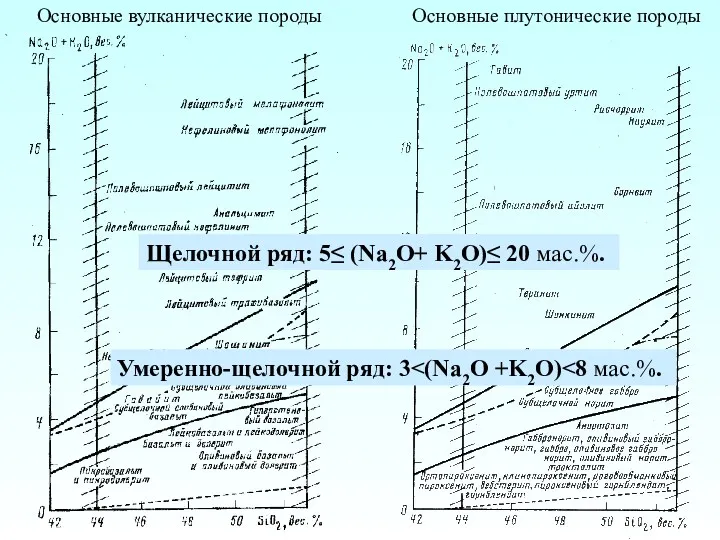 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы λ-MnO2 as material with pseudocapacitive properties
λ-MnO2 as material with pseudocapacitive properties Электролиз Урок для 11 класса
Электролиз Урок для 11 класса Теории происхождения нефти
Теории происхождения нефти Полибутадиен
Полибутадиен Алкандар. Метан және оның құрылысы
Алкандар. Метан және оның құрылысы