Содержание
- 2. ИСТОРИЧЕСКИЕ СВЕДЕНИЯ Серная кислота известна с древности. Первое упоминание о кислых газах, получаемых при прокаливании квасцов
- 3. ИСТОРИЧЕСКИЕ СВЕДЕНИЯ В XV веке алхимики обнаружили, что серную кислоту можно получить, сжигая смесь серы и
- 4. ФИЗИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ Се́рная кислота́ H2SO4 — сильная двухосновная кислота, отвечающая высшей степени окисления серы
- 5. ТОКСИЧЕСКОЕ ДЕЙСТВИЕ НА ОРГАНИЗМ Серная кислота и олеум — чрезвычайно агрессивные вещества, поражают дыхательные пути, кожу,
- 6. Серная кислота прожигает бумагу, ткани, обугливает сахар Действие серной кислоты на бумагу Действие серной кислоты на
- 7. ТЕХНИКА БЕЗОПАСНОСТИ ПРИ ПРИГОТОВЛЕНИИ РАСТВОРА СЕРНОЙ КИСЛОТЫ Относительно смешивания серной кислоты с водой с давних пор
- 8. Автоцистерна для перевозки серной кислоты
- 9. Серная кислота в природе Кислые озёра
- 10. Существуют предположения, что кислотное озеро возникло сравнительно недавно в результате извержения, произошедшего незаметно для людей. Тот,
- 11. Озеро шириной 500 м и глубиной 140 м состоит из прогретого до 40 градусов раствора серной
- 12. В природе встречается 180 минералов сульфатов, и на их долю приходится ~0,5 % массы земной коры.
- 13. Сульфат кальция Сульфат бария В Мексике не так давно обнаружили пещеру с 15-метровыми кристаллами гипса! 2Н2О)
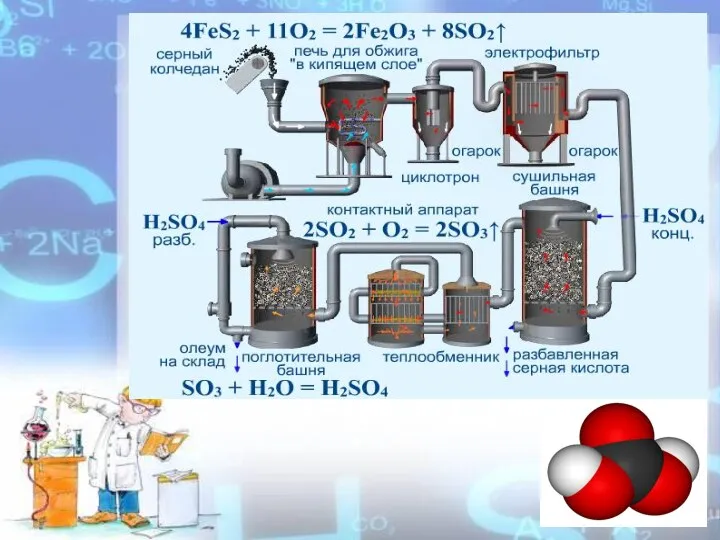
- 14. Промышленное получение H2SO4 S SO2 SO3 H2SO4 S+O2=SO2 2SO2+O2=2SO3 SO3+H2O=H2SO4
- 15. FeS2 S H2S SO2 → SO3 → H2SO4 Пирит Серный колчедан Получение серной кислоты
- 17. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ (характерны для класса кислот) серная кислота H2SO4 + индикатор = изменение окраски
- 18. I. Химические свойства разбавленной серной кислоты 1.Диссоциация: H2SO4 = H+ + HSO4- HSO4- ↔ H+ +
- 19. 3. Взаимодействие с оcновными и амфотерными оксидами CuO + H2SO4 → CuSO4 + H2O CuO +
- 20. 4. Взаимодействие с основаниями и амфотерными гидроксидами 2NaOH + H2SO4 → Na2SO4 +2 H2O H+ +
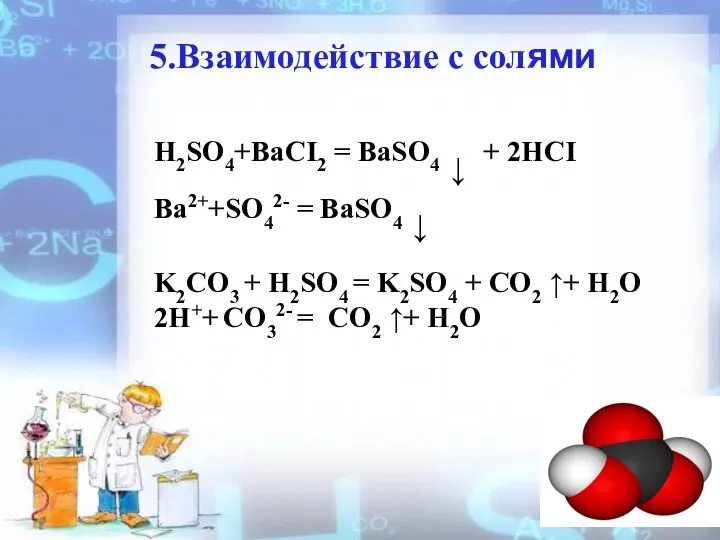
- 21. 5.Взаимодействие с солями H2SO4+BaCI2 = BaSO4 ↓ + 2HCI Ba2++SO42- = BaSO4 ↓ K2CO3 + H2SO4
- 22. Качественная реакция H2SO4+BaCI2 = BaSO4 ↓ + 2HCI Ba2+ + SO42- = BaSO4↓
- 23. Серная кислота вытесняет более летучие кислоты NaCI + H2SO4 → NaHSO4 + HCI
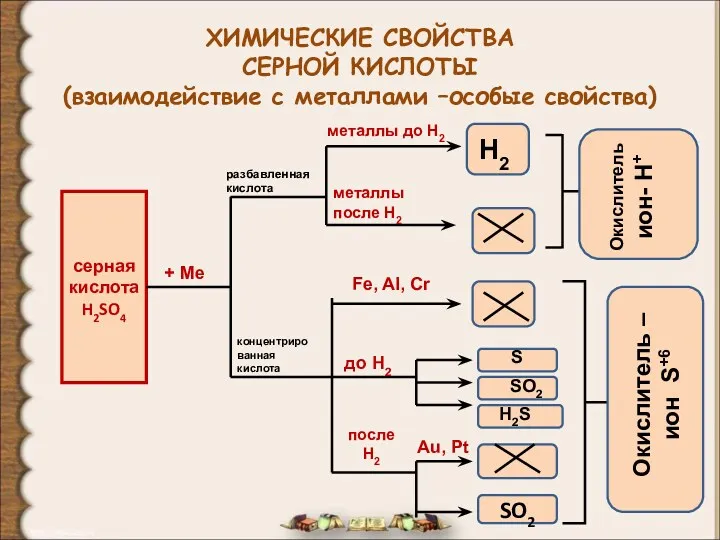
- 24. ХИМИЧЕСКИЕ СВОЙСТВА СЕРНОЙ КИСЛОТЫ (взаимодействие с металлами –особые свойства) серная кислота H2SO4 + Ме разбавленная кислота
- 25. концентрированная серная кислота окисляет неметаллы неМе + H2SO4(конц.) = H2O + SO2 + кислородсодержащая кислота неМе,
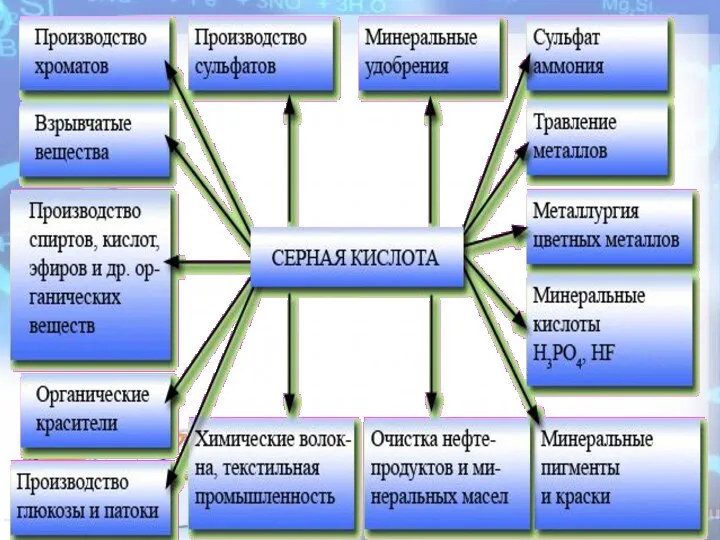
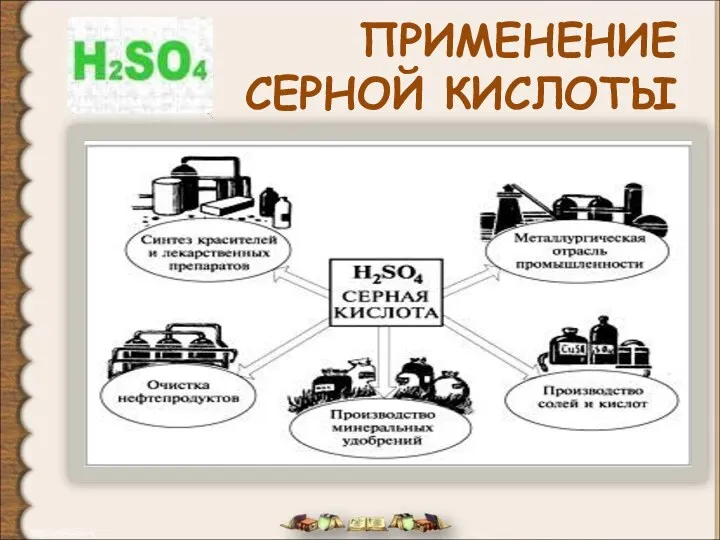
- 26. Нет кислоты, которая была бы нужнее и применялась бы чаще, чем серная. Главным образом, ее применяют
- 28. ПРИМЕНЕНИЕ СЕРНОЙ КИСЛОТЫ
- 30. Скачать презентацию






















 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями