Содержание
- 2. Особенность строения карбонильной группы >C=O, заключается в полярности связи между атомами С и О. Двойная связь
- 3. Физические свойства Муравьиный альдегид – в обычных условиях – газ, уксусный альдегид – летучая жидкость, ацетон
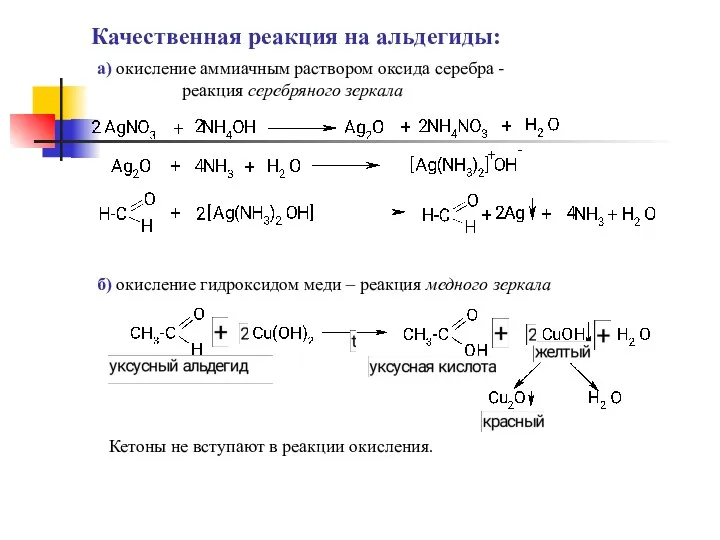
- 4. Качественная реакция на альдегиды: а) окисление аммиачным раствором оксида серебра - реакция серебряного зеркала б) окисление
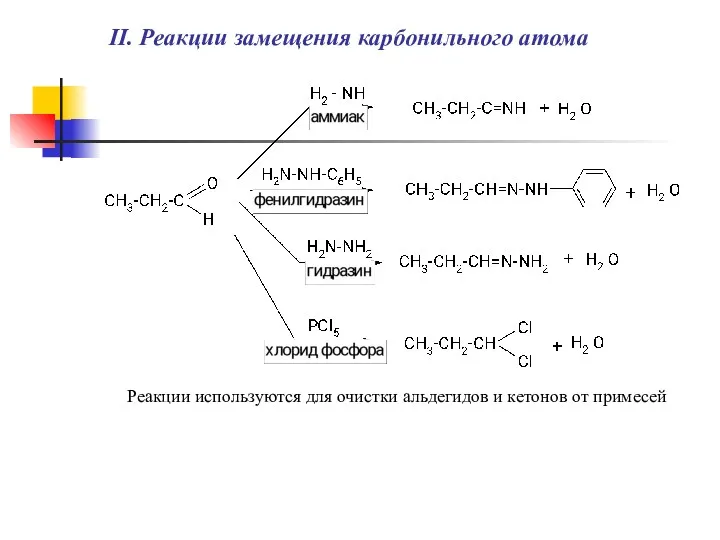
- 5. II. Реакции замещения карбонильного атома Реакции используются для очистки альдегидов и кетонов от примесей
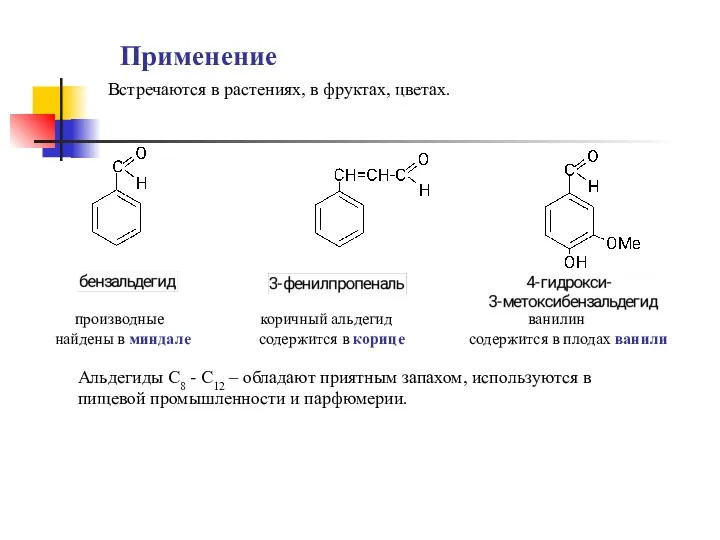
- 6. Применение производные коричный альдегид ванилин найдены в миндале содержится в корице содержится в плодах ванили Альдегиды
- 7. Водный раствор – формалин, для хранения анатомических препаратов; В сельском хозяйстве для дезинфекции зерно- и овощехранилищ,
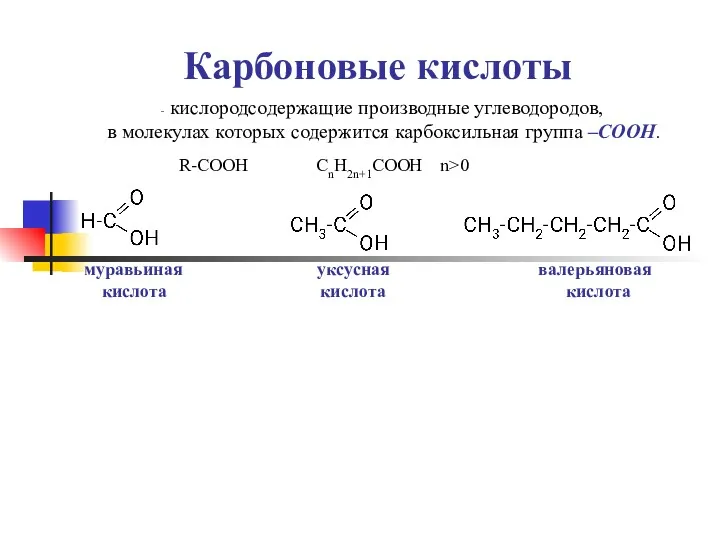
- 8. Карбоновые кислоты кислородсодержащие производные углеводородов, в молекулах которых содержится карбоксильная группа –СООН. R-COOH СnH2n+1COOH n>0 муравьиная
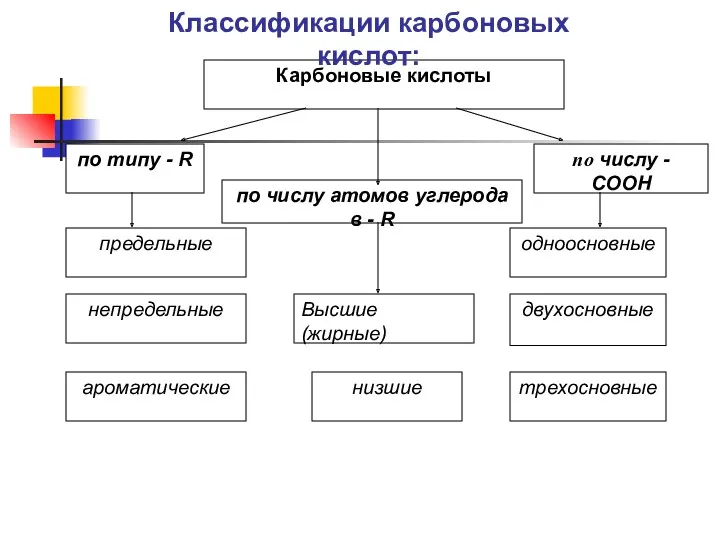
- 9. Карбоновые кислоты по типу - R по числу - COOH предельные непредельные ароматические одноосновные двухосновные трехосновные
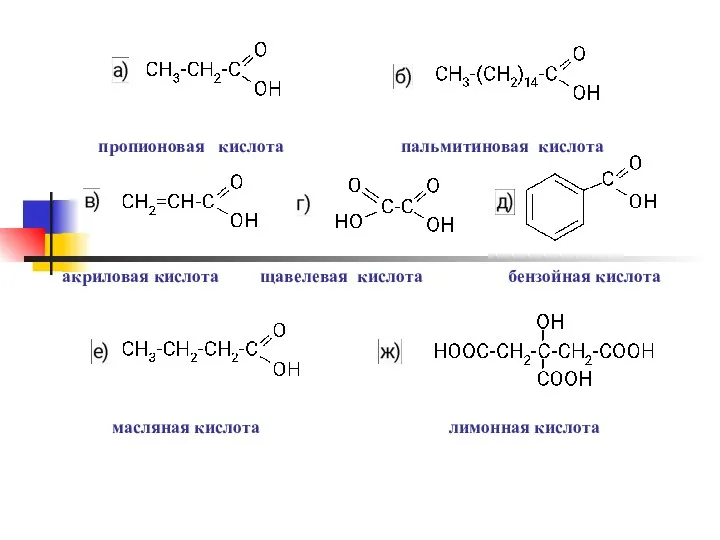
- 10. пропионовая кислота пальмитиновая кислота акриловая кислота щавелевая кислота бензойная кислота масляная кислота лимонная кислота
- 11. Название по систематической (международной) номенклатуре: 1. Выбираем главную цепь, в которой находиться карбоксильная группа. 2. Нумеруем
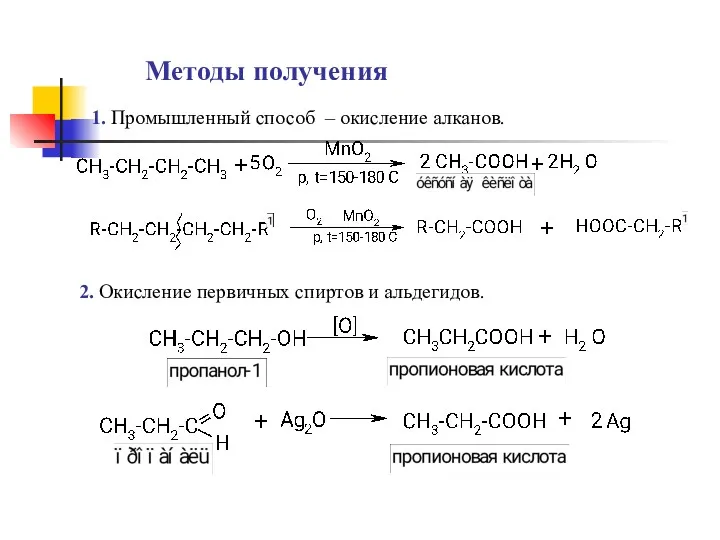
- 12. Методы получения 1. Промышленный способ – окисление алканов. 2. Окисление первичных спиртов и альдегидов.
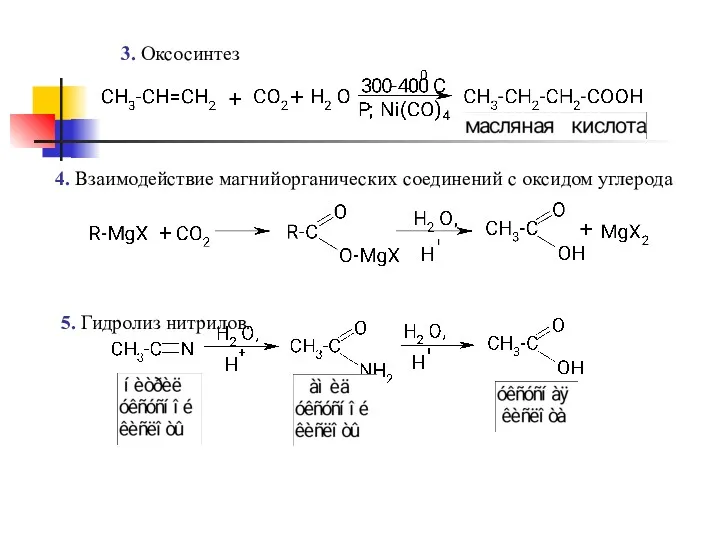
- 13. 3. Оксосинтез 4. Взаимодействие магнийорганических соединений с оксидом углерода 5. Гидролиз нитрилов.
- 14. Физические свойства уксусной кислоты: Агрегатное состояние жидкое Цвет бесцветная прозрачная жидкость Запах резкий уксусный Растворимость в
- 15. Химические свойства Карбоновые кислоты обладают большей кислотностью, чем спирты, но являются более слабыми, чем минеральные кислоты.
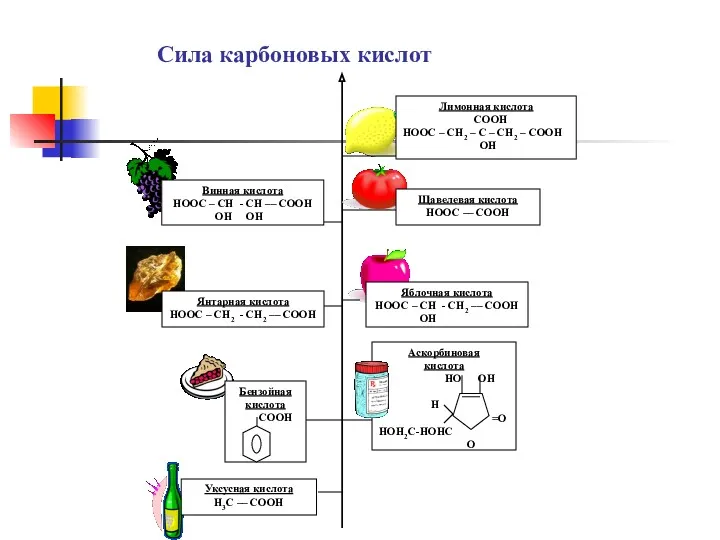
- 16. Сила карбоновых кислот
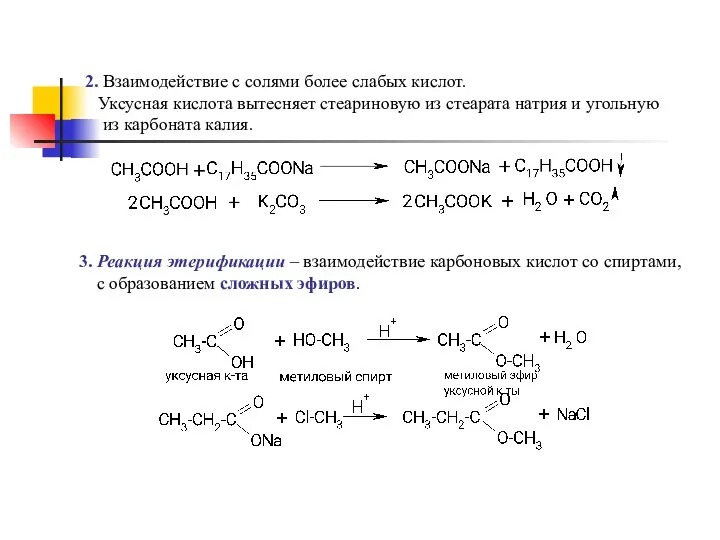
- 17. 2. Взаимодействие с солями более слабых кислот. Уксусная кислота вытесняет стеариновую из стеарата натрия и угольную
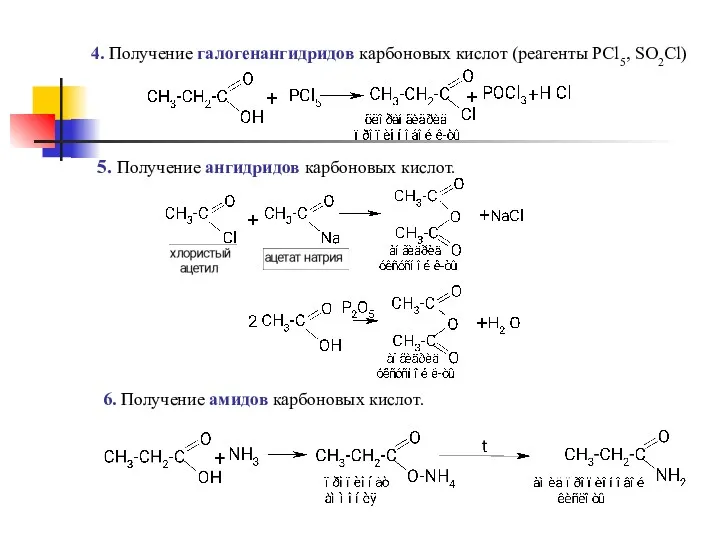
- 18. 4. Получение галогенангидридов карбоновых кислот (реагенты PCl5, SO2Cl) 5. Получение ангидридов карбоновых кислот. 6. Получение амидов
- 19. III. Индивидуальные свойства карбоновых кислот. 7. Окисление муравьиной кислоты, в условиях реакции серебряного зеркала. 8. Полимеризация
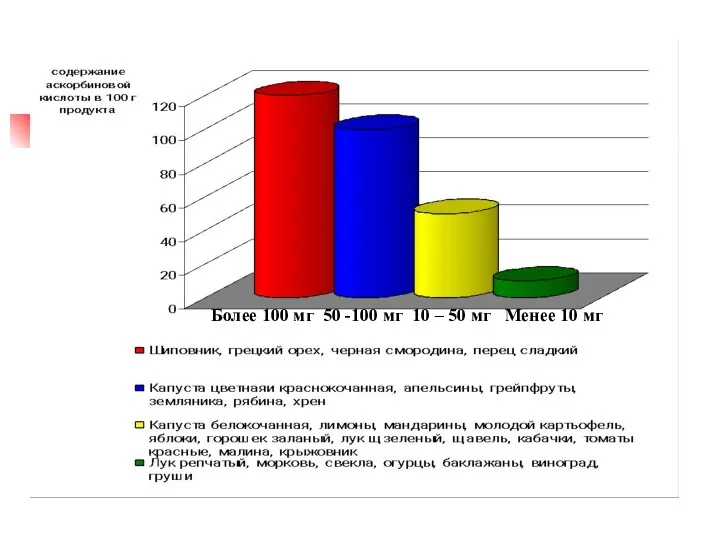
- 20. Более 100 мг 50 -100 мг 10 – 50 мг Менее 10 мг
- 22. Скачать презентацию







 Классификация минералов по химическому принципу. Занятие 9
Классификация минералов по химическому принципу. Занятие 9 Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру
Донор-акцепторлы және алмасу механизмі бойынша ковалентті байланыстың түзілуін түсіндіру Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева
Характеристика химического элемента по его положению в периодической системе химических элементов Д.И. Менделеева Химия и продукты питания
Химия и продукты питания Оценка опасности взрыва горючих газов
Оценка опасности взрыва горючих газов Золото
Золото Этанол. Одноатомный спирт
Этанол. Одноатомный спирт Важнейшие нефтепродукты. Области их применения
Важнейшие нефтепродукты. Области их применения 29 Кинетика идеальных проточных ректоров (2)
29 Кинетика идеальных проточных ректоров (2) Полиамиды. Классификация по методу получения
Полиамиды. Классификация по методу получения Метанол, етанол та їхнє застосування
Метанол, етанол та їхнє застосування Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли
Соединения фосфора: оксид фосфора (V). Ортофосфорная кислота и ее соли Занимательные опыты
Занимательные опыты Роль металлов в нашей жизни
Роль металлов в нашей жизни Керамические материалы
Керамические материалы Нитрофенилалкиламины
Нитрофенилалкиламины Использование уксусной кислоты в жизни
Использование уксусной кислоты в жизни Сильные и слабые электролиты. Кислотность среды. 9 класс
Сильные и слабые электролиты. Кислотность среды. 9 класс Растворы. Часть 2
Растворы. Часть 2 Методы осаждения. Аналитическая химия
Методы осаждения. Аналитическая химия Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Центрифугирование
Центрифугирование Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе
Применение методов кислотно-основного титрования в неводных средах в современном фармакопейном анализе Общая характеристика элементов главной подгруппы второй группы
Общая характеристика элементов главной подгруппы второй группы fosfor_i_ego_soedineniya
fosfor_i_ego_soedineniya Хімічний склад жувальної гумки
Хімічний склад жувальної гумки Извлечение из растворов экстракцией органическими растворителями
Извлечение из растворов экстракцией органическими растворителями