Содержание
- 3. Алюминий и его соединения
- 4. Нахождение в природе
- 5. Получение алюминия Впервые алюминий был получен датским физиком Гансом Эрстедом в 1825 году действием амальгама калия
- 6. Физические свойства плотность (при 20°С) 2,7 г/см3; tпл 660,24°С; tкип около 2500°С; высокие теплопровод-ность и электрическую
- 7. Химические свойства Окисляется на воздухе: 4Al + 3O2 = 2Al2O3 Вытесняет водород из воды (амальгам алюминия
- 8. Оксид алюминия Аl2O3 Очень твердый порошок белого цвета. Образуется: а) при окислении или горении алюминия: 4Al
- 9. Гидроксид алюминия AI(OH)3 Белый нерастворимый в воде порошок Проявляет амфотерные свойства. Взаимодействует: а) с кислотами: Al(OH)3
- 11. Скачать презентацию







 Полимеры
Полимеры Теория строения органических веществ А.М. Бутлеров
Теория строения органических веществ А.М. Бутлеров Молибден. Нахождение в природе
Молибден. Нахождение в природе Процесс в химическом реакторе
Процесс в химическом реакторе Розв’язування експериментальних задач (9 клас)
Розв’язування експериментальних задач (9 клас) Растворы. Основные понятия. Концентрация. Законы Рауля
Растворы. Основные понятия. Концентрация. Законы Рауля Химия в косметологии
Химия в косметологии Күрделі эфирлер
Күрделі эфирлер Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Процессы проявления и фиксирования
Процессы проявления и фиксирования Элемент V группы фосфор
Элемент V группы фосфор Применение закона действующих масс к гетерогенным равновесиям. Ионное произведение растворимости. (Лекция 5)
Применение закона действующих масс к гетерогенным равновесиям. Ионное произведение растворимости. (Лекция 5) Классификация химических элементов в географической оболочке
Классификация химических элементов в географической оболочке Теплота згоряння. Температура горіння
Теплота згоряння. Температура горіння Основи
Основи Титриметрический метод анализа
Титриметрический метод анализа Геохимия. Проблемы геохимии. Геохимические методы
Геохимия. Проблемы геохимии. Геохимические методы Простые вещества (урок для 8 класса)
Простые вещества (урок для 8 класса) ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Буферные растворы
Буферные растворы Поверхностная модификация дисперсных систем
Поверхностная модификация дисперсных систем Основные физико-химические свойства нефти и нефтепродуктов
Основные физико-химические свойства нефти и нефтепродуктов Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Гидролиз солей
Гидролиз солей Химиялық байланыс және заттардың құрылымдық түрлі сатылары
Химиялық байланыс және заттардың құрылымдық түрлі сатылары Чистые вещества и смеси
Чистые вещества и смеси Строение атома кремния
Строение атома кремния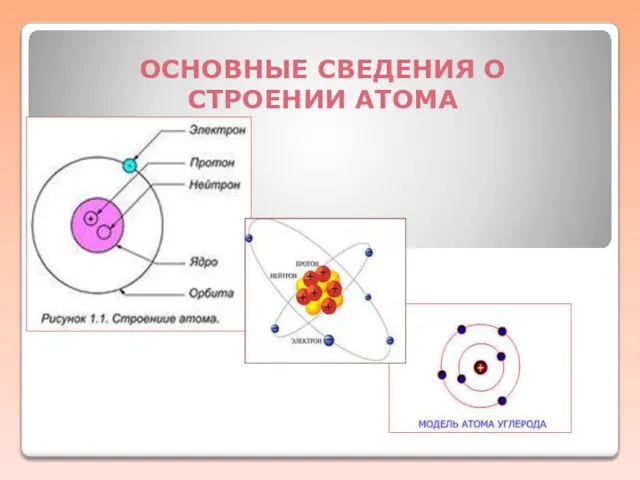 Основные сведения о строении атома
Основные сведения о строении атома