Содержание
- 2. это процессы, в результате которых из одних веществ образуются другие, отличающиеся от них по составу и
- 3. По числу и составу реагирующих и образующихся веществ По изменению степени окисления атомов элементов По использованию
- 4. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие без изменения состава веществ. В
- 5. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 1.
- 6. Горение серы в кислороде: Классификация химических реакций
- 7. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 2.
- 8. Получение кислорода из перманганата калия: Классификация химических реакций
- 9. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 3.
- 10. Взаимодействие натрия с водой: Классификация химических реакций
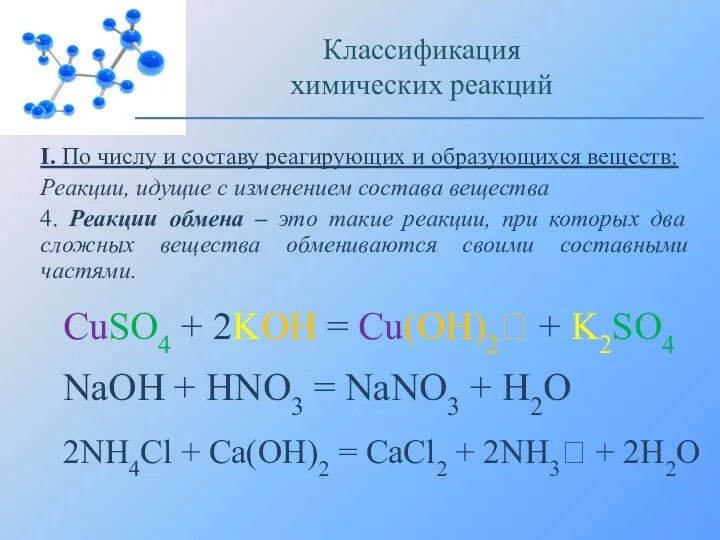
- 11. I. По числу и составу реагирующих и образующихся веществ: Реакции, идущие с изменением состава вещества 4.
- 12. Получение аммиака из нашатыря Классификация химических реакций
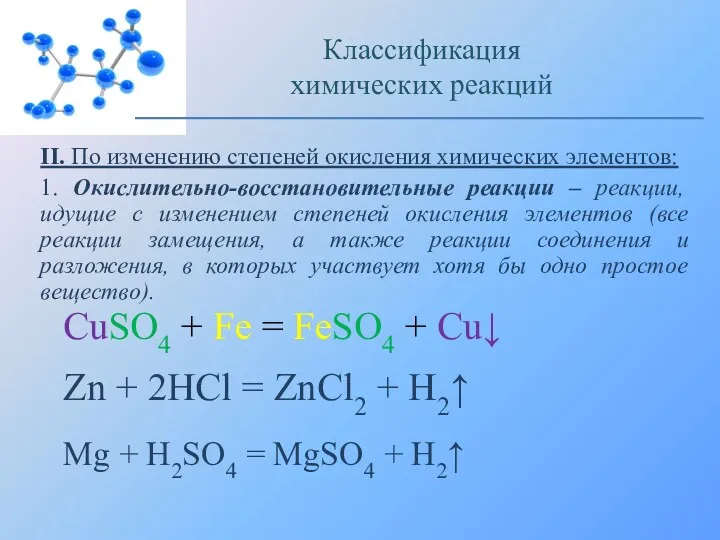
- 13. II. По изменению степеней окисления химических элементов: 1. Окислительно-восстановительные реакции – реакции, идущие с изменением степеней
- 14. Взаимодействие железа с медным купоросом: Классификация химических реакций
- 15. III. По использованию катализатора: 1. Некаталитические реакции – реакции, идущие без участия катализатора: Классификация химических реакций
- 16. III. По использованию катализатора: 1. Каталитические реакции – реакции, идущие с участием катализатора: Классификация химических реакций
- 17. Разложение пероксида водорода: Классификация химических реакций
- 18. IV. По направлению: 1. Необратимые реакции протекают в данных условиях только в одном направлении: Классификация химических
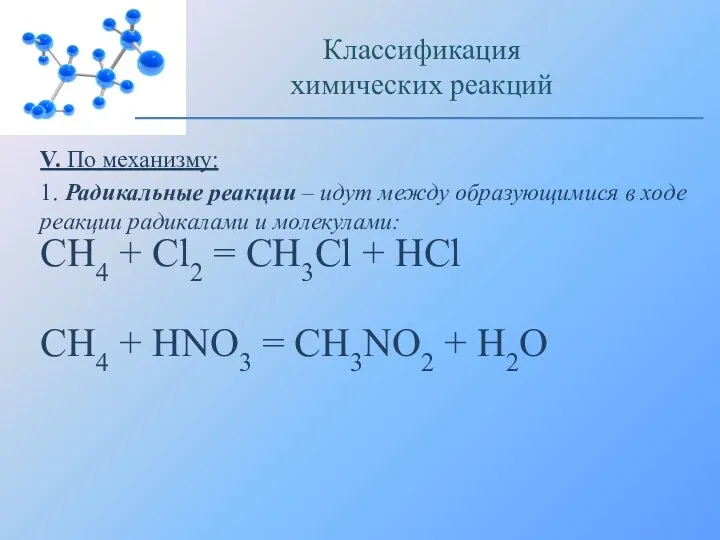
- 19. V. По механизму: 1. Радикальные реакции – идут между образующимися в ходе реакции радикалами и молекулами:
- 20. V. По механизму: 2. Ионные реакции – идут между уже имеющимися или образующимися в ходе реакции
- 21. VI. По тепловому эффекту: 1. Экзотермические реакции протекают с выделением энергии: Классификация химических реакций 4P +
- 22. Горение фосфора в кислороде: Классификация химических реакций
- 23. VI. По тепловому эффекту: 2. Эндотермические реакции протекают с поглощением энергии: Классификация химических реакций N2 +
- 24. Разложение оксида ртути: Классификация химических реакций
- 25. VII. По виду энергии, инициирующей реакцию: Фотохимические реакции инициируются световой энергией. Радиационные реакции инициируются излучениями большой
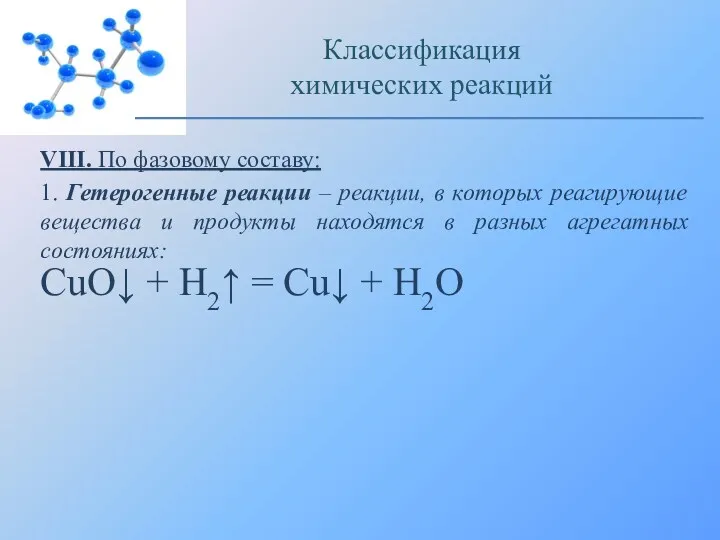
- 26. VIII. По фазовому составу: 1. Гетерогенные реакции – реакции, в которых реагирующие вещества и продукты находятся
- 27. Восстановление оксида меди (II) водородом: Классификация химических реакций
- 29. Скачать презентацию






















 Классификация моторных масел
Классификация моторных масел Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики
Создание пилотной производства 500 тонн в год рафинированного металлургического кремния Si 99,99% для нужд солнечной энергетики Электродные процессы
Электродные процессы Технология производства бутилкаучука
Технология производства бутилкаучука Роль хімії у житті суспільства
Роль хімії у житті суспільства Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Дендример, или арборол
Дендример, или арборол Изомерия. Типы изомерии
Изомерия. Типы изомерии Основания. Обобщение
Основания. Обобщение Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства
Колебания кристаллической решетки и ее тепловые свойства. Тепловые свойства КИСЛОРОД
КИСЛОРОД Лекция 1. Введение в биоорганическую химию
Лекция 1. Введение в биоорганическую химию Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Alkynes
Alkynes Инструментальные методы исследования органических веществ
Инструментальные методы исследования органических веществ Синтетические моющие средства. Механизм моющего действия
Синтетические моющие средства. Механизм моющего действия Боевые отравляющие вещества
Боевые отравляющие вещества Требования к осадителю
Требования к осадителю Арены - ароматические соединения
Арены - ароматические соединения Белки. Функции белков
Белки. Функции белков Дисперсные системы в медицине и пищевой промышленности
Дисперсные системы в медицине и пищевой промышленности Азот. Фосфор
Азот. Фосфор Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Химия лекция (вебинар)
Химия лекция (вебинар) Дисперсные системы
Дисперсные системы Галогенопроизводные углеводородов
Галогенопроизводные углеводородов Розчин та його компоненти
Розчин та його компоненти Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)
Группа веществ, изолируемых из биологического объекта путём минерализации (Металлические яды)