Содержание
- 2. В атоме кислорода 8 электронов, при этом 2 электрона находятся на внутреннем уровне, а 6 электронов
- 3. Распространение в природе Кислород — самый распространенный на Земле элемент, на его долю (в составе различных
- 4. Физические свойства При нормальных условиях кислород — это газ без цвета, вкуса и запаха. 1 л
- 5. Химические свойства
- 6. Сильный окислитель, взаимодействует практически со всеми элементами, образуя оксиды. Степень окисления −2. Как правило, реакция окисления
- 7. Окисляет соединения, которые содержат элементы с не максимальной степенью окисления: 2NO + O2 = NO2 Окисляет
- 8. Кислород образует пероксиды со степенью окисления −1. Например, пероксиды получаются при сгорании щелочных металлов в кислороде:
- 9. С неметаллами: S + O2 = SO2 P + O2 = P2O5 C + O2 =
- 10. ПОЛУЧЕНИЕ КИСЛОРОДА Небольшие количества кислорода можно получать нагреванием перманганата калия KMnO4: 2KMnO4 → K2MnO4 + MnO2
- 11. Кислород можно получить каталитическим разложением хлората калия (бертолетовой соли) KClO3: 2KClO3 → 2KCl + 3O2↑ К
- 12. Применение В металлургии Ракетное топливо В медицине В пищевой промышленности В химической промышленности В сельском хозяйстве
- 13. Биологическая роль кислорода Большинство живых существ (аэробы) дышат кислородом воздуха. Широко используется кислород в медицине. При
- 15. Скачать презентацию











 Польза и вред химического производства
Польза и вред химического производства Серная кислота. Занимательные опыты
Серная кислота. Занимательные опыты Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Хімічні явища в побуті
Хімічні явища в побуті Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Альдегиды и кетоны
Альдегиды и кетоны Полипропилен
Полипропилен Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Химия p-элементов
Химия p-элементов Энергоресурсы и их использование
Энергоресурсы и их использование Основные понятия и законы химии
Основные понятия и законы химии Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химические волокна (7 класс)
Химические волокна (7 класс) Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Качественные реакции на органические вещества
Качественные реакции на органические вещества Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот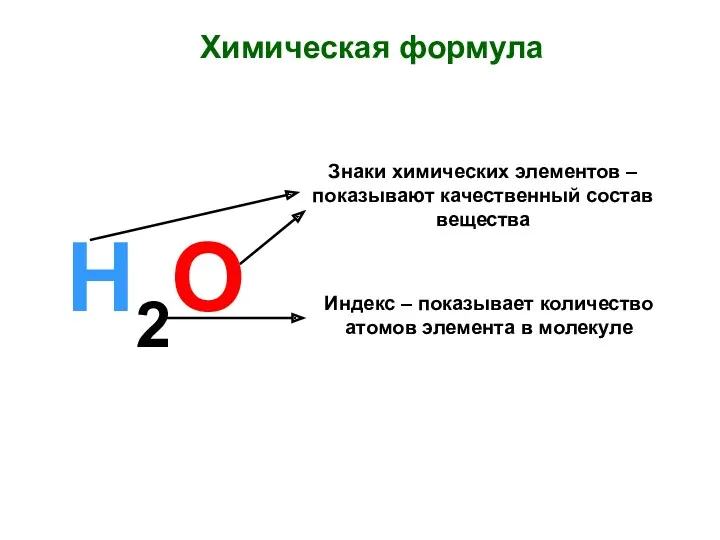 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Азот
Азот Глицерин. Основные способы получения
Глицерин. Основные способы получения Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Такой разный песок
Такой разный песок Каучук. Открытие каучука
Каучук. Открытие каучука Щелочные металлы
Щелочные металлы Кристаллохимия как наука
Кристаллохимия как наука Каталитический риформинг бензинов
Каталитический риформинг бензинов Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Концентрация кобальта
Концентрация кобальта