Слайд 2
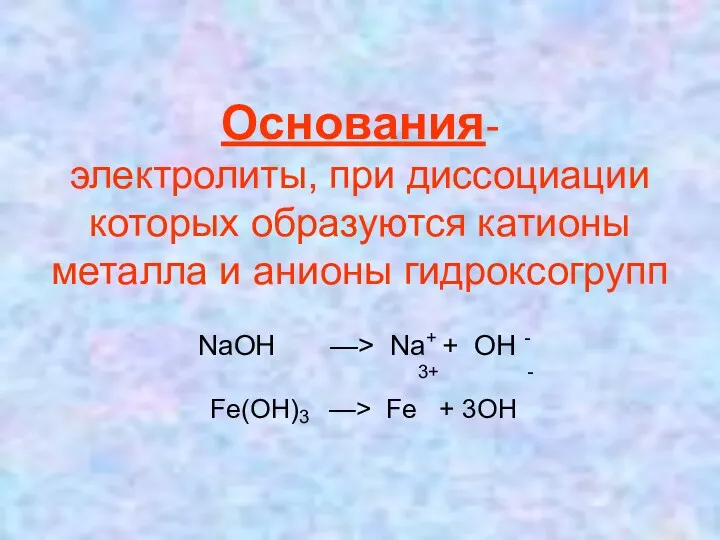
Основания-
электролиты, при диссоциации которых образуются катионы металла и анионы гидроксогрупп
NaOH —> Na+ + OH -
3+ -
Fe(OH)3 —> Fe + 3OH
Слайд 3
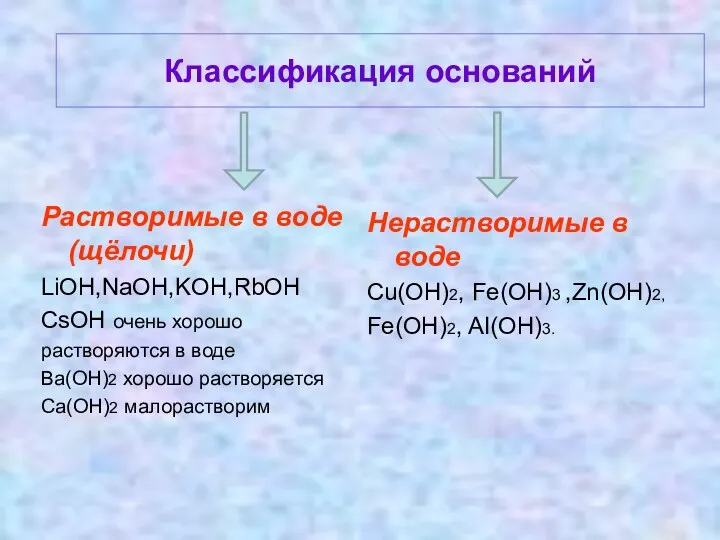
Классификация оснований
Растворимые в воде (щёлочи)
LiOH,NaOH,KOH,RbOH
CsOH очень хорошо
растворяются в воде
Ba(OH)2 хорошо растворяется
Ca(OH)2
малорастворим
Нерастворимые в воде
Cu(OH)2, Fe(OH)3 ,Zn(OH)2,
Fe(OH)2, AI(OH)3.
Слайд 4

Название оснований
Гидроксид
+
Название металла в родительном падеже
+
Валентность римскими цифрами
Слайд 5

Степень окисления гидроксогруппы –
Количество гидроксогрупп определяется валентностью металла, образующего
основание.
Например:
+1 +2 +3
Na OH, Ca (OH)2 , Fe (OH)3
Слайд 6

Изменение окраски индикатора в щелочной среде
Бесцветный фенолфталеин—малиновый
Метиловый оранжевый—желтый
лакмус—синий
Слайд 7
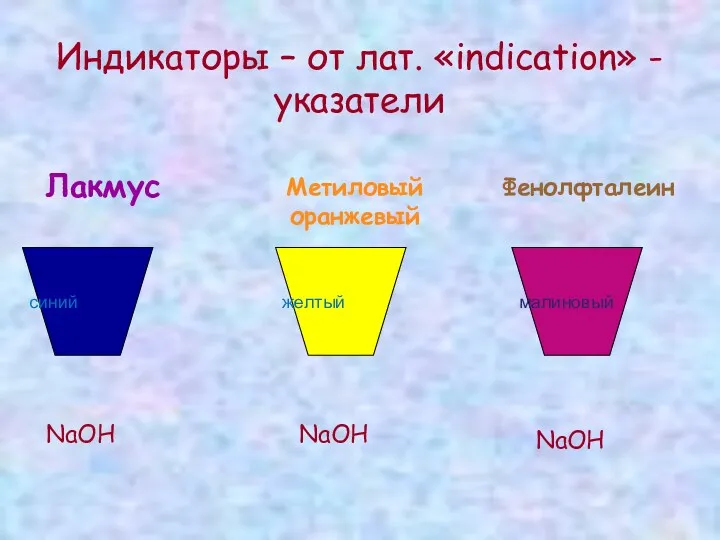
Индикаторы – от лат. «indication» - указатели
Лакмус
синий
NaOH
Метиловый оранжевый
желтый
NaOH
Фенолфталеин
малиновый
NaOH
Слайд 8

Типичные реакции растворимых оснований
РЕАГИРУЮТ С КИСЛОТАМИ
2KOH + H2SO4 —> K2SO4 +
2H2O
РЕАГИРУЮТ С РАСТВОРАМИ СОЛЕЙ
CuCI2 + 2KOH = Cu(OH)2 + 2KCI
РЕАГИРУЮТ С КИСЛОТНЫМИ ОКСИДАМИ
2KOH + CO2 —> K2CO3 + H2O
Слайд 9

Типичные реакции нерастворимых оснований
РЕАГИРУЮТ С КИСЛОТАМИ
2Fe(OH)3 + 3H2SO4—>Fe2(SO4)3+6H2O
ПРИ НАГРЕВАНИИ
РАЗЛАГАЮТСЯ
2Fe(OH)3 —> Fe2O3 + 3H2O
Слайд 10

ПРОВЕРЬ СЕБЯ
1.Формула основания это:
а) NaOH в) CuCL2
б) HCL г)
SO3
2. Лакмус в растворе, полученном при взаимодействии оксида кальция с водой:
а) синий в) фиолетовый
б) красный г) малиновый
3. С раствором гидроксида натрия взаимодействует:
а) оксид магния в) оксид цинка
б) оксид углерода г) сера
4. Нерастворимое основание при нагревании разлагаются:
а) Fe(OH)3 в) NaOH
б) Ba(OH)2 г) НСL
5. Пара ионов, которая может одновременно находится в растворе:
а) H+ и SiO3 в) Н+ и SO42-
б) Cu 2+ и ОН- г) Ag+ и CL-
6. Пара веществ взаимодействующих друг с другом:
а) H2SO4 u SiO2 в) Сu u H3PO4
б) CuO u Na2O г) НСl u NaOH









 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды