Содержание
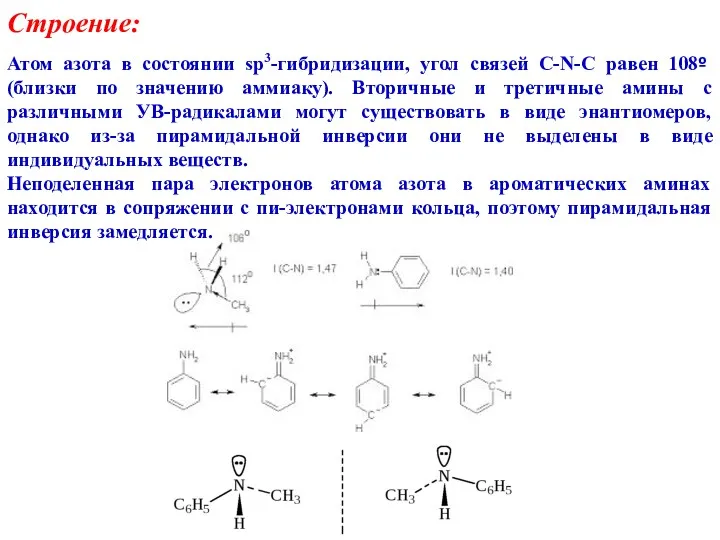
- 2. Строение: Атом азота в состоянии sp3-гибридизации, угол связей C-N-C равен 108º (близки по значению аммиаку). Вторичные
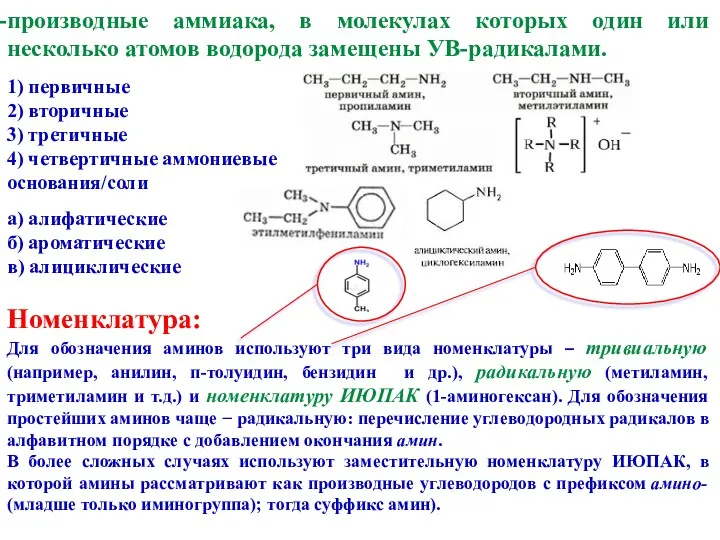
- 3. производные аммиака, в молекулах которых один или несколько атомов водорода замещены УВ-радикалами. 1) первичные 2) вторичные
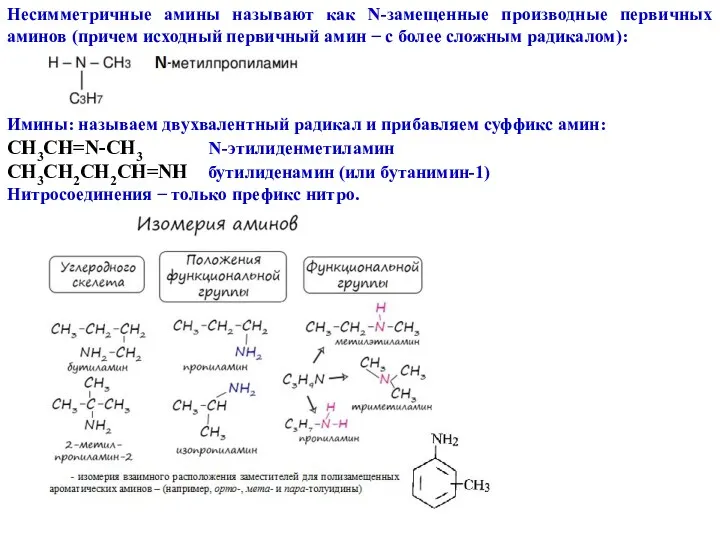
- 4. Несимметричные амины называют как N-замещенные производные первичных аминов (причем исходный первичный амин − с более сложным
- 5. Физические свойства: Низшие представители – газы с запахом аммиака. Хорошо растворимы в воде. Высшие – жидкости,
- 6. Получение: т.к. азот имеет низшую СО, многие способы заключаются в восстановлении других азотсодержащих соединений. 1. В
- 7. 4. Из галогенопроизводных: Первичные амины а) C2H5Br + NH3 = C2H5NH3Br (гидробромид этиламмония) б) C2H5NH3Br +
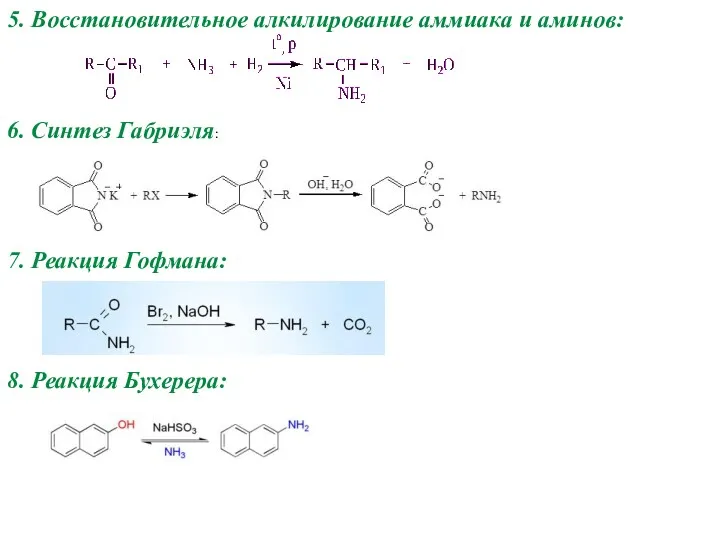
- 8. 5. Восстановительное алкилирование аммиака и аминов: 6. Синтез Габриэля: 7. Реакция Гофмана: 8. Реакция Бухерера:
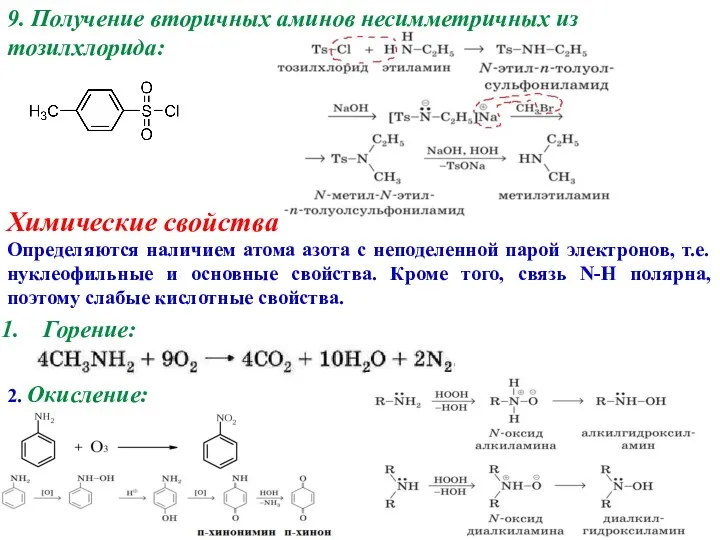
- 9. 9. Получение вторичных аминов несимметричных из тозилхлорида: Химические свойства Определяются наличием атома азота с неподеленной парой
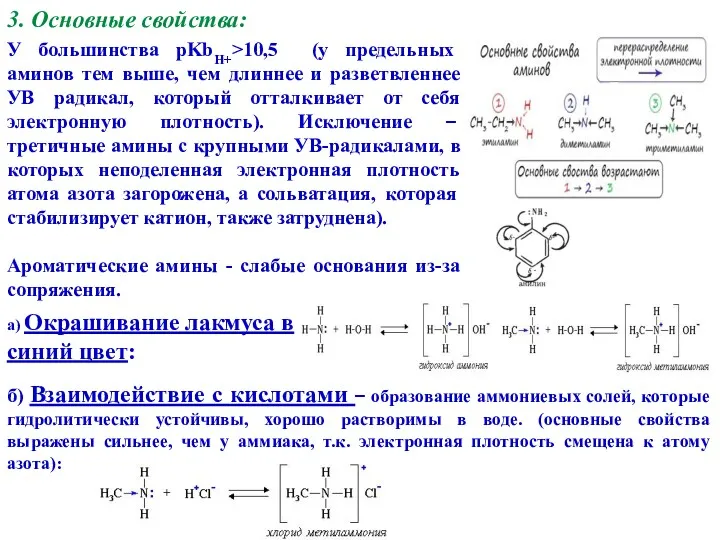
- 10. 3. Основные свойства: У большинства pKbH+>10,5 (у предельных аминов тем выше, чем длиннее и разветвленнее УВ
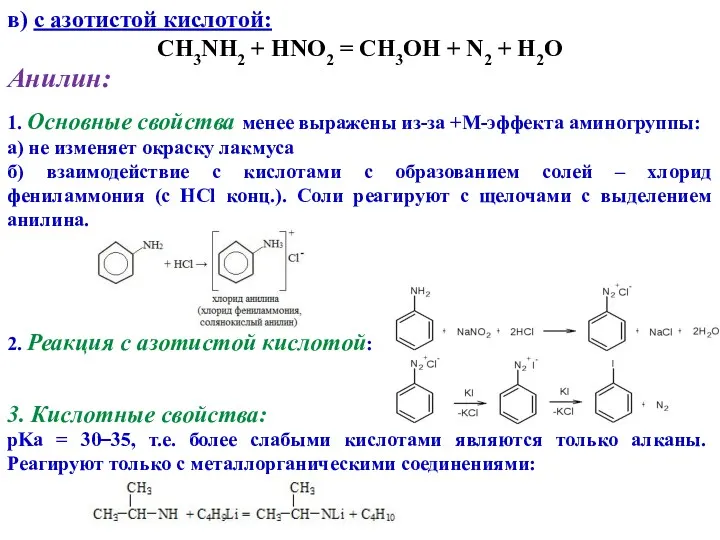
- 11. в) с азотистой кислотой: CH3NH2 + HNO2 = CH3OH + N2 + H2O Анилин: 1. Основные
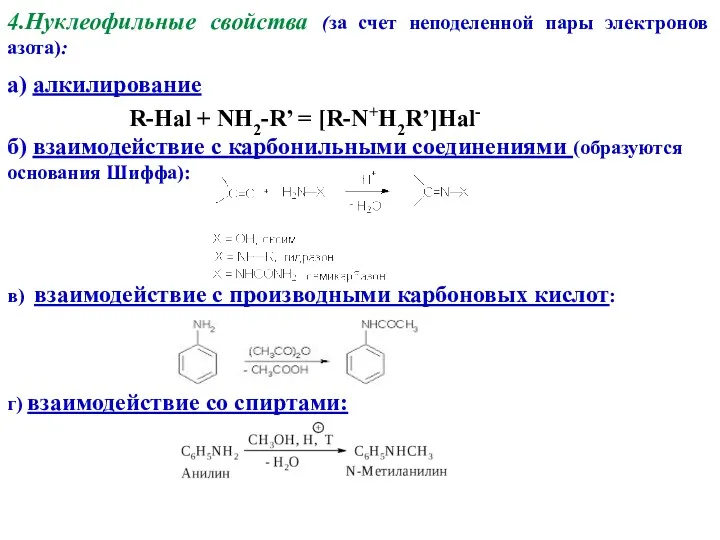
- 12. 4.Нуклеофильные свойства (за счет неподеленной пары электронов азота): а) алкилирование R-Hal + NH2-R’ = [R-N+H2R’]Hal- б)
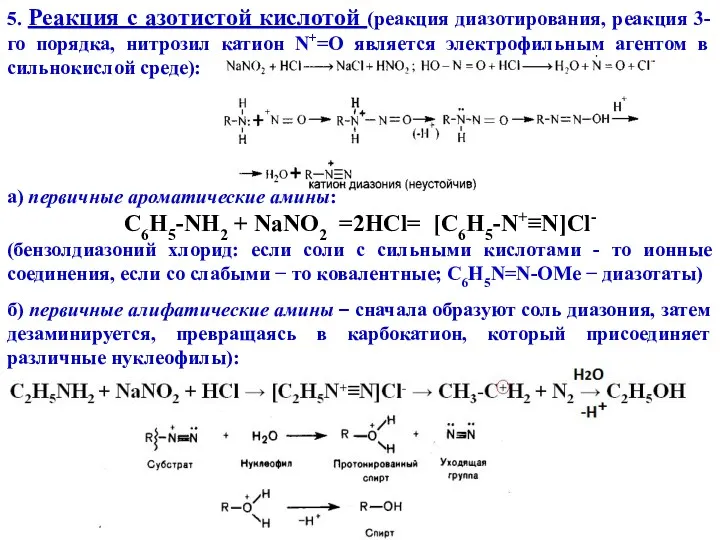
- 13. 5. Реакция с азотистой кислотой (реакция диазотирования, реакция 3-го порядка, нитрозил катион N+=O является электрофильным агентом
- 14. в) Вторичные амины – образуют N-нитрозамины (сильные канцерогены, образуются в ЖКТ при восстановлении нитратов растений до
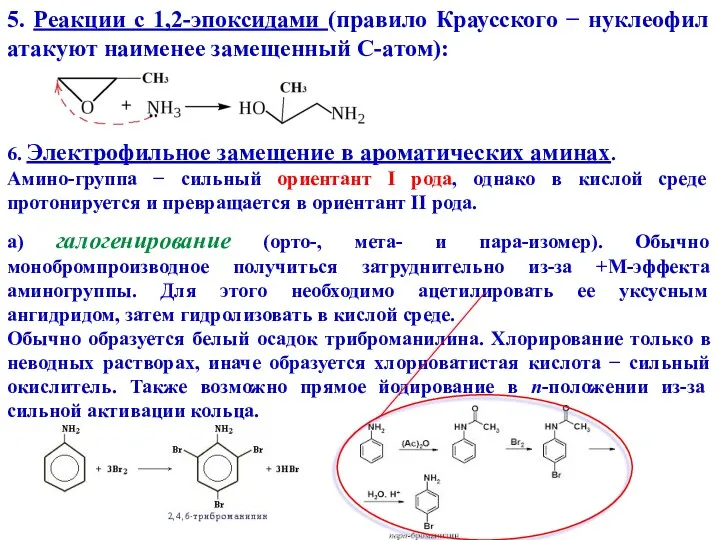
- 15. 5. Реакции с 1,2-эпоксидами (правило Краусского − нуклеофил атакуют наименее замещенный С-атом): 6. Электрофильное замещение в
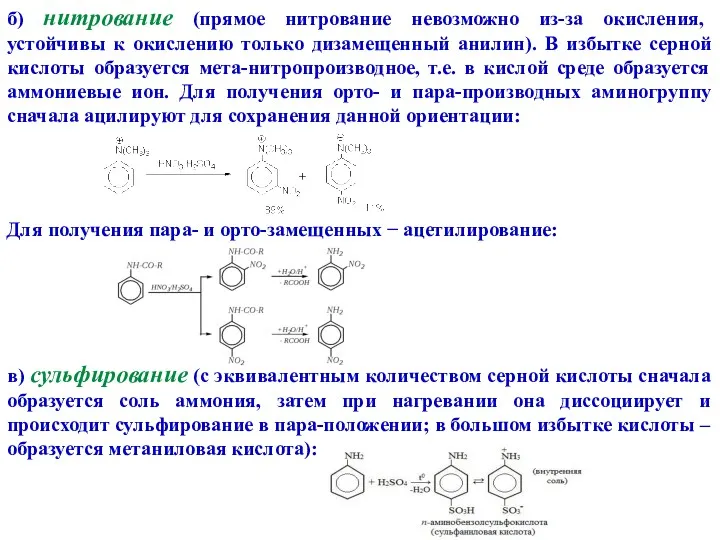
- 16. б) нитрование (прямое нитрование невозможно из-за окисления, устойчивы к окислению только дизамещенный анилин). В избытке серной
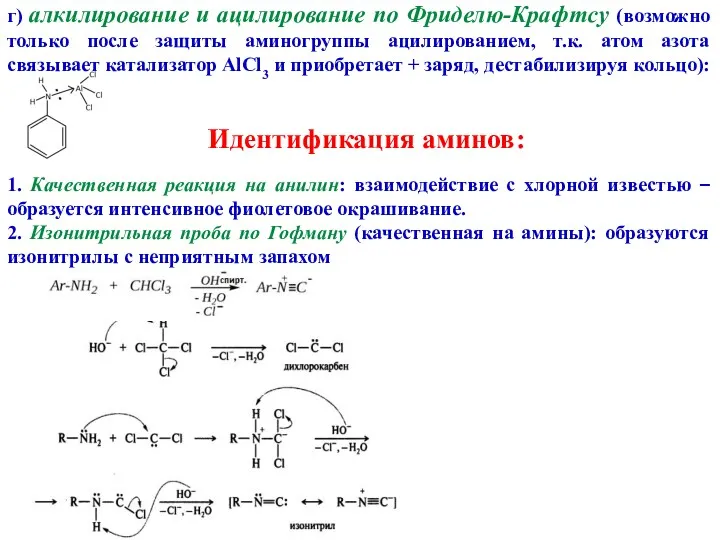
- 17. г) алкилирование и ацилирование по Фриделю-Крафтсу (возможно только после защиты аминогруппы ацилированием, т.к. атом азота связывает
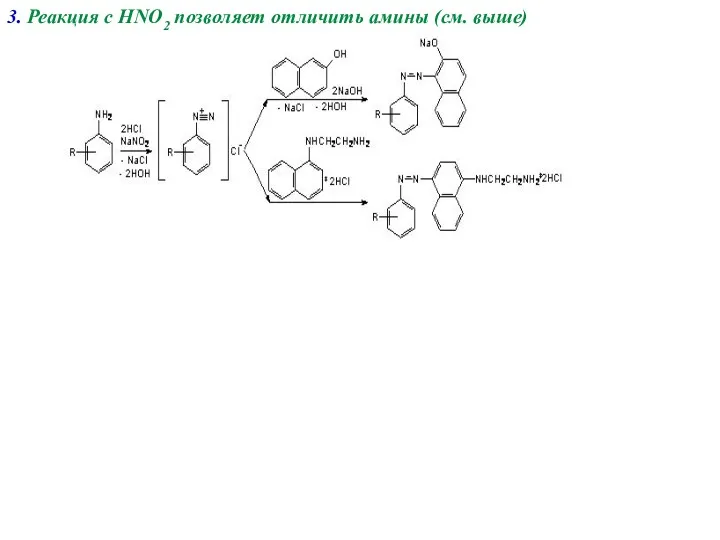
- 18. 3. Реакция с HNO2 позволяет отличить амины (см. выше)
- 20. Скачать презентацию




 Соединения химических элементов. Урок-игра. 8 класс
Соединения химических элементов. Урок-игра. 8 класс Комплексонометрия – метод количественного титриметрического анализа
Комплексонометрия – метод количественного титриметрического анализа Экстракционные методы выделения продуктов микробиологического синтеза
Экстракционные методы выделения продуктов микробиологического синтеза Химическая связь
Химическая связь Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6
Общая характеристика и источники сырья производств основного органического и нефтехимического синтеза. Лекция № 5-6 большая стирка
большая стирка Алкадиены. Гомологический ряд, номенклатура и изомерия
Алкадиены. Гомологический ряд, номенклатура и изомерия Химическая связь
Химическая связь Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату Ароматические соединения - арены
Ароматические соединения - арены Водородная связь
Водородная связь Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей
Электролиты и неэлектролиты. Катионы и анионы. Электролитическая диссоциация кислот, щелочей и солей Атомный и ионный радиусы. Принципы шаровых упаковок
Атомный и ионный радиусы. Принципы шаровых упаковок Азот и его соединения
Азот и его соединения Технология оптического стекла
Технология оптического стекла Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Электрохимические процессы
Электрохимические процессы Простые вещества
Простые вещества Кислород
Кислород Ароматические соединения (арены)
Ароматические соединения (арены) Алкалоидтар
Алкалоидтар Лекция 2. Строение атома и Периодический закон Д.И. Менделеева
Лекция 2. Строение атома и Периодический закон Д.И. Менделеева Тепловой эффект химических реакций. 8 класс
Тепловой эффект химических реакций. 8 класс Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Общая характеристика твердого, жидкого и газообразного видов топлива
Общая характеристика твердого, жидкого и газообразного видов топлива Химия в строительстве
Химия в строительстве Кислотные и основные свойства органических соединений
Кислотные и основные свойства органических соединений Углерод
Углерод