Содержание
- 2. РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА Капустин В.М., Гуреев А.А. Технология переработки нефти. Часть 2. Физико-химические процессы. (2015 г.) Смидович
- 3. ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ТЕХНОЛОГИЮ ТОПЛИВ И УГЛЕРОДНЫХ МАТЕРИАЛОВ
- 4. 1 Классификация химических (деструктивных) процессов 2 Теоретические основы химических процессов 3 Технологические основы процессов 4 Скорость
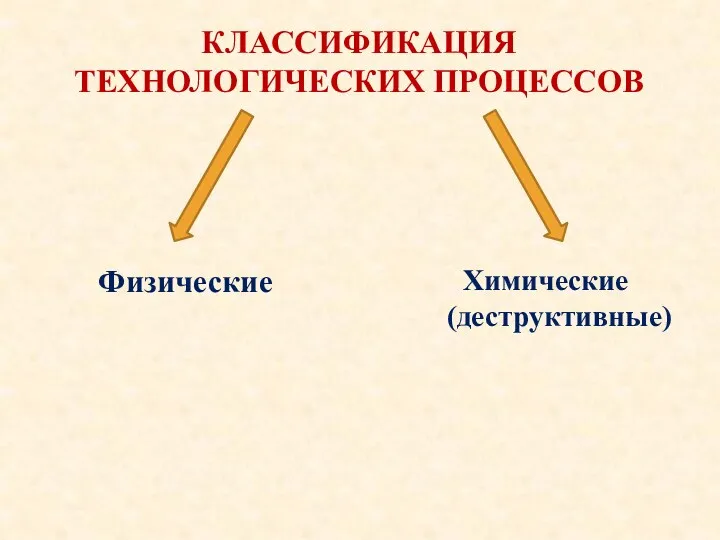
- 5. Физические Химические (деструктивные) КЛАССИФИКАЦИЯ ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ
- 6. Термические процессы Термокаталитические процессы Гидрогенизационные (термогидрокаталитические) процессы Процессы по переработке легких углеводородных фракций КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ
- 7. ТЕРМИЧЕСКИЕ ПРОЦЕССЫ
- 8. ТЕРМОКАТАЛИТИЧЕСКИЕ ПРОЦЕССЫ
- 9. ГИДРОГЕНИЗАЦИОННЫЕ ПРОЦЕССЫ
- 10. ПРОЦЕССЫ ПЕРЕРАБОТКИ ЛЕГКИХ УГЛЕВОДОРОДНЫХ ФРАКЦИЙ
- 11. КЛАССИФИКАЦИЯ ХИМИЧЕСКИХ ПРОЦЕССОВ ПЕРЕРАБОТКИ НЕФТИ Направленные на углубление переработки нефти Направленные на облагораживание нефтепродуктов для повышения
- 12. ГЛУБИНА ПЕРЕРАБОТКИ НЕФТИ Gн – объем переработки нефти Gкт – выработка котельного топлива Gпг – выработка
- 13. УВЕЛИЧЕНИЕ ГЛУБИНЫ ПЕРЕРАБОТКИ Нефть АВТ Г Б К ДТ ВГ Гудрон 2 10 15 15 20
- 14. НАПРАВЛЕННЫЕ НА УГЛУБЛЕНИЕ ПЕРЕРАБОТКИ НЕФТИ Технологические процессы Термический крекинг Висбрекинг Каталитический крекинг Коксование Гидрокрекинг Пиролиз остаточного
- 15. НАПРАВЛЕННЫЕ НА ОБЛАГОРАЖИВАНИЕ НЕФТЕПРОДУКТОВ, ПОВЫШЕНИЕ ИХ КАЧЕСТВА Технологические процессы Изомеризация Алкилирование Каталитический риформинг Гидрогенизационные процессы: гидроочистка
- 16. НАПРАВЛЕННЫЕ НА ПОЛУЧЕНИЕ СПЕЦПРОДУКТОВ ИЛИ СЫРЬЯ ДЛЯ НЕФТЕХИМИИ Технологические процессы Коксование Каталитический риформинг Пиролиз Производство битумов
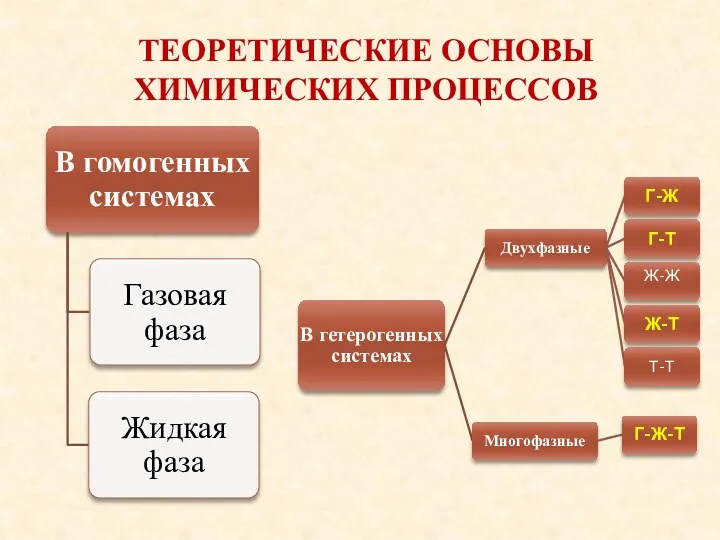
- 17. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ С позиций изменения структуры молекул углеводородного сырья протекают химические процессы: Термолиз Катализ
- 18. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Суммарный технологический процесс состоит из стадий: Подвод реагирующих компонентов в зону реакции
- 19. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Подвод реагирующих компонентов в зону реакции Молекулярная диффузия Конвекция (при интенсивном перемешивании
- 20. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ В многофазных системах – подвод реагирующих компонентов совершается: - Абсорбцией - Адсорбцией
- 21. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Химические реакции – основа физико-химического процесса Превращение вещества проходит через ряд последовательных
- 22. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Отвод полученных продуктов из зоны реакции: - Диффузией - Конвекцией Суммарная скорость
- 23. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Процесс протекает в кинетической области – если наиболее медленно происходит сама химическая
- 24. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Технологический режим – совокупность основных факторов (параметров), влияющих на скорость процесса, выход
- 25. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ Агрегатное состояние реагирующих веществ определяет способы их технологической переработки и принципы конструирования
- 26. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ХИМИЧЕСКИХ ПРОЦЕССОВ
- 27. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ 1. Равновесие реакций - Все реакции обратимы - Во многих реакциях равновесие смещено
- 28. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ Все обратимые процессы стремятся к равновесию (Wпр=Wобр) Соотношение компонентов во взаимодействующих системах остается
- 29. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ Примеры 1. А+Б=В+Q (в газовой фазе) 2. А=Б+В-Q ( в газовой фазе) 3.
- 30. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ 2. Выход продукта – в зависимости от условий процесса определяется как степень превращения,
- 31. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ Равновесный выход – отношение количества основного исходного вещества, фактически превращенного в продукт Gр,
- 32. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ Фактический выход – отношение фактически полученного продукта Gф к его количеству, которое получалось
- 33. ТЕХНОЛОГИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ 3. Глубина процесса (степень превращения сырья) – характеризуется долей превращенного сырья «Условно непревращенное
- 34. СКОРОСТЬ ПРОЦЕССОВ И ТЕПЛОВЫЕ ЭФФЕКТЫ 1. Скорость процессов Скорость гомогенных реакций Wi – количество одного из
- 35. СКОРОСТЬ ПРОЦЕССОВ И ТЕПЛОВЫЕ ЭФФЕКТЫ Температура (технологический параметр) описывается уравнением Аррениуса, где k – константа скорости
- 36. СКОРОСТЬ ПРОЦЕССОВ И ТЕПЛОВЫЕ ЭФФЕКТЫ Скорость гетерогенного процесса Wа – скорость процесса по реагенту А а-
- 37. СКОРОСТЬ ПРОЦЕССОВ И ТЕПЛОВЫЕ ЭФФЕКТЫ Способы увеличения скорости процесса Увеличение константы скорости процесса Увеличение движущей силы
- 38. УВЕЛИЧЕНИЕ КОНСТАНТЫ СКОРОСТИ ПРОЦЕССА
- 39. УВЕЛИЧЕНИЕ ДВИЖУЩЕЙ СИЛЫ ПРОЦЕССА
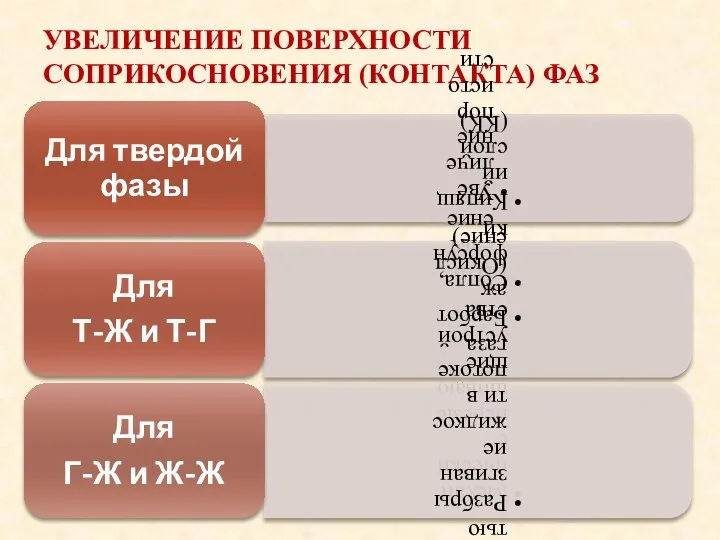
- 40. УВЕЛИЧЕНИЕ ПОВЕРХНОСТИ СОПРИКОСНОВЕНИЯ (КОНТАКТА) ФАЗ
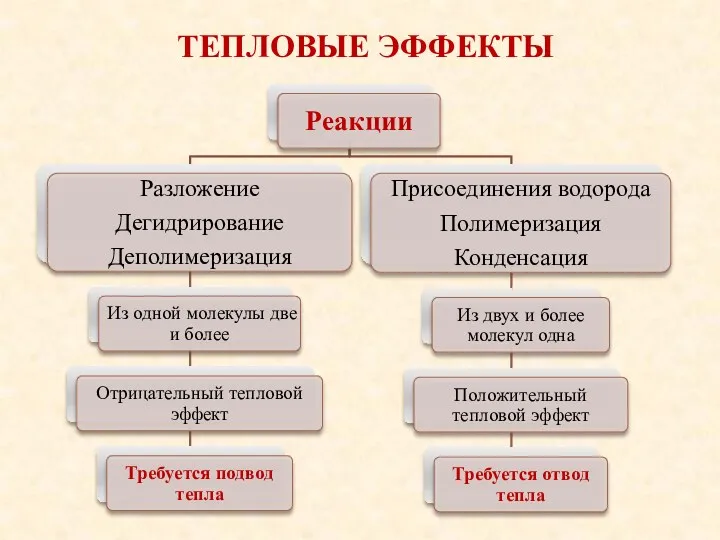
- 41. ТЕПЛОВЫЕ ЭФФЕКТЫ Отрицательный – для осуществления процесса необходимо затрачивать некоторое количество теплоты Положительный – происходит выделение
- 42. ТЕПЛОВЫЕ ЭФФЕКТЫ Тепловой эффект химической реакции не зависит от пути перехода одного вещества в другое, а
- 43. ТЕПЛОВЫЕ ЭФФЕКТЫ
- 45. Скачать презентацию






































 Металлы и сплавы с высокой удельной прочностью
Металлы и сплавы с высокой удельной прочностью Химическая термодинамика
Химическая термодинамика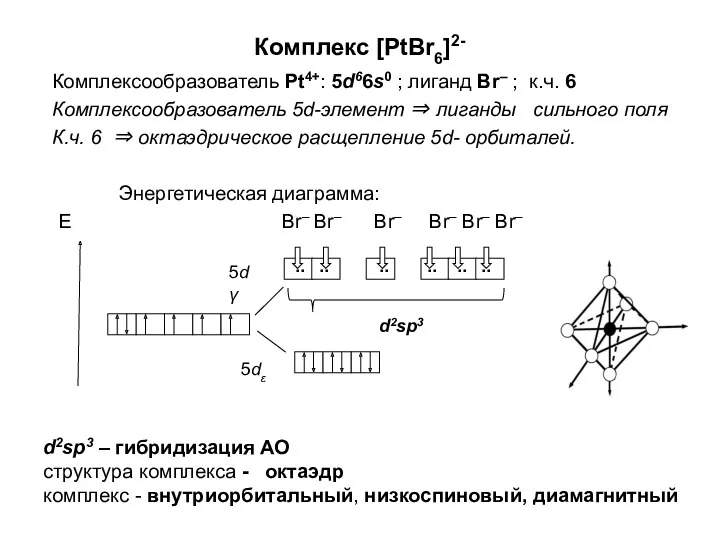 Комплексообразователь. (Лекция 5)
Комплексообразователь. (Лекция 5)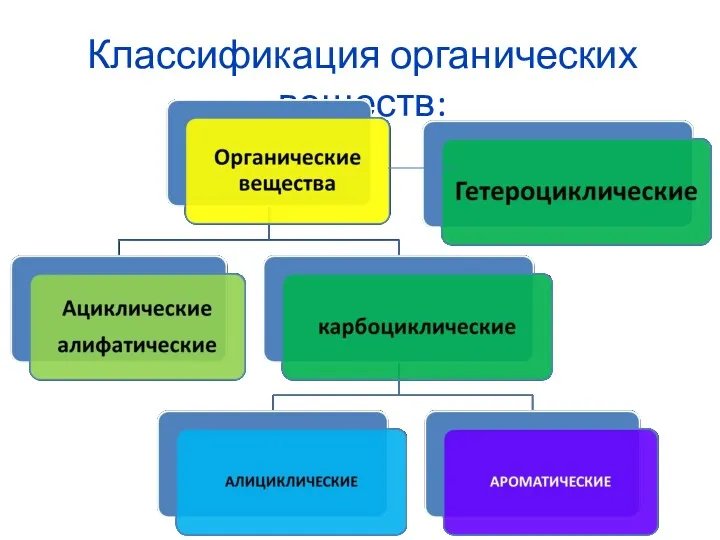 Классификация органических веществ
Классификация органических веществ Сравнительная характеристика галогенов
Сравнительная характеристика галогенов Амин қышқылдар
Амин қышқылдар Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость
Металлы и сплавы, их строение. Классификация и маркировка сталей. Влияние химических элементов на свариваемость Фенол и его свойства. (10 класс)
Фенол и его свойства. (10 класс) Строение атома
Строение атома Липиды. Классификация липидов
Липиды. Классификация липидов Крахмал. Строение вещества
Крахмал. Строение вещества Значення хімії у житті людини
Значення хімії у житті людини Определение нефтепродуктов в воде с использованием Флюората-02-5М
Определение нефтепродуктов в воде с использованием Флюората-02-5М Каменный уголь
Каменный уголь Экспертные системы распознавания химических веществ
Экспертные системы распознавания химических веществ Бензо́л (C6H6, PhH)
Бензо́л (C6H6, PhH) Поняття про валентність. Ребус
Поняття про валентність. Ребус Текстовые задачи на проценты, смеси и сплавы
Текстовые задачи на проценты, смеси и сплавы Строение и свойства металлов. Физические и механические свойства металлов
Строение и свойства металлов. Физические и механические свойства металлов Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей
Игровая программа по химии Самый умный. Химические свойства оксидов, оснований, кислот и солей Природные источники углеводородов
Природные источники углеводородов Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия
Покрытия: виды, принципы создания, свойства, применение. Получение покрытий золь-гель методом. Супергидрофобные покрытия Органическая химия
Органическая химия 21. Кислоты. Определение кислот
21. Кислоты. Определение кислот Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Общая характеристика неметаллов
Общая характеристика неметаллов Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы
Сера. Аллотропия серы. Физические и химические свойства серы. Применение серы Р-элементы VI A группы. Свойства их соединений
Р-элементы VI A группы. Свойства их соединений