Содержание
- 2. Классификация спиртов Спирты классифицируют по различным структурным признакам 1. По числу гидроксильных групп спирты подразделяются на
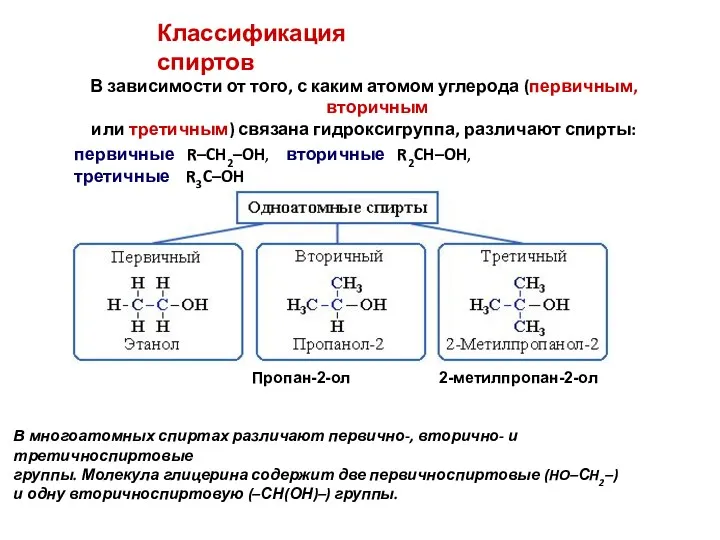
- 3. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты:
- 4. Классификация спиртов По строению радикалов, связанных с атомом кислорода, спирты подразделяются на: предельные, или алканолы R-CH2–OH
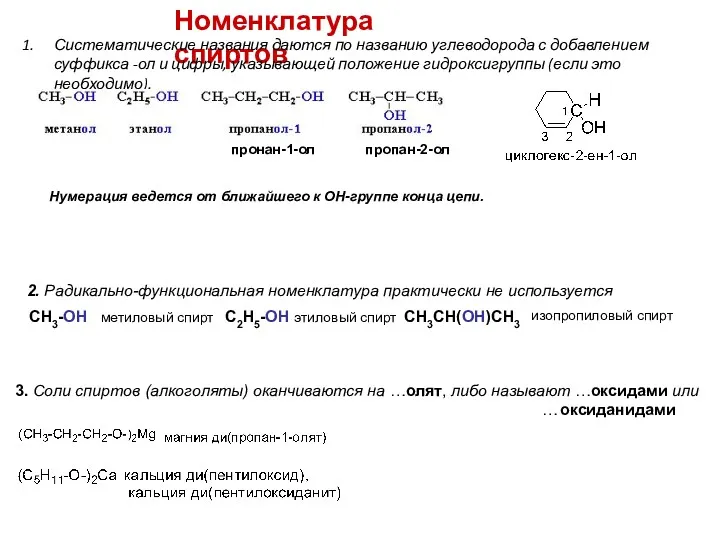
- 5. Номенклатура спиртов Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение
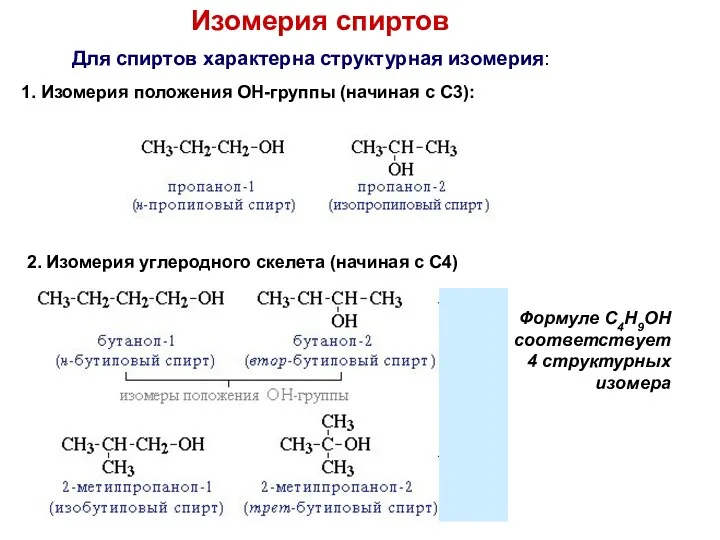
- 6. Изомерия спиртов Для спиртов характерна структурная изомерия: 1. Изомерия положения ОН-группы (начиная с С3): 2. Изомерия
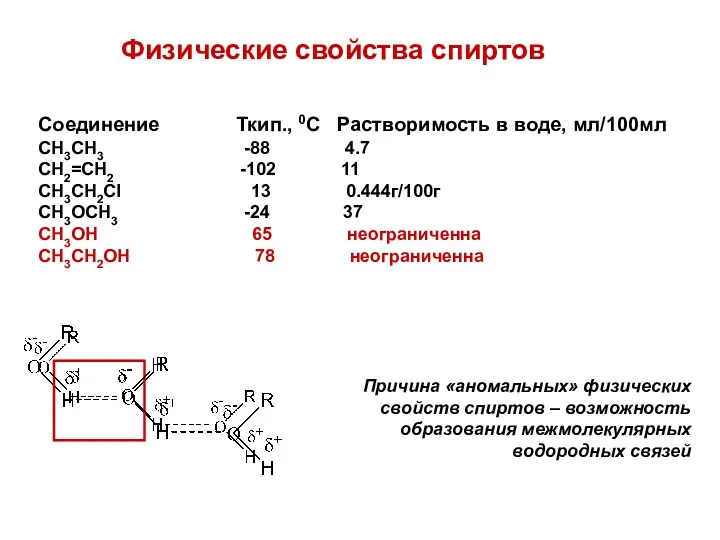
- 7. Физические свойства спиртов Соединение Ткип., 0С Растворимость в воде, мл/100мл CH3CH3 -88 4.7 CH2=CH2 -102 11
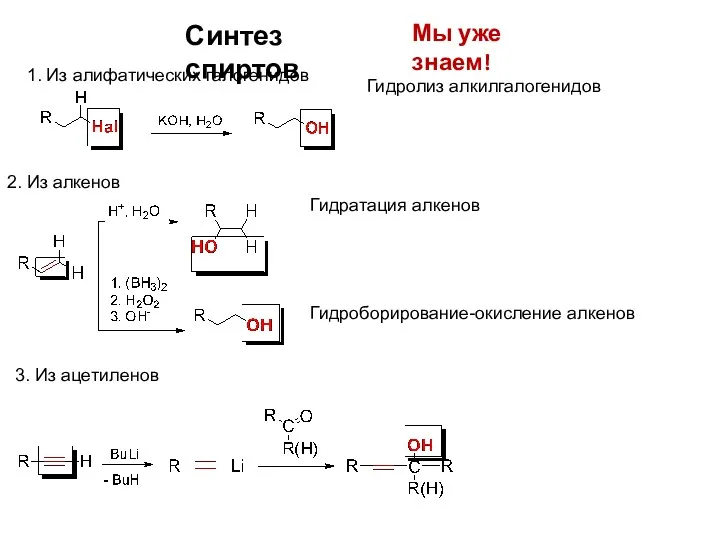
- 8. Синтез спиртов Мы уже знаем! 1. Из алифатических галогенидов 2. Из алкенов Гидратация алкенов Гидролиз алкилгалогенидов
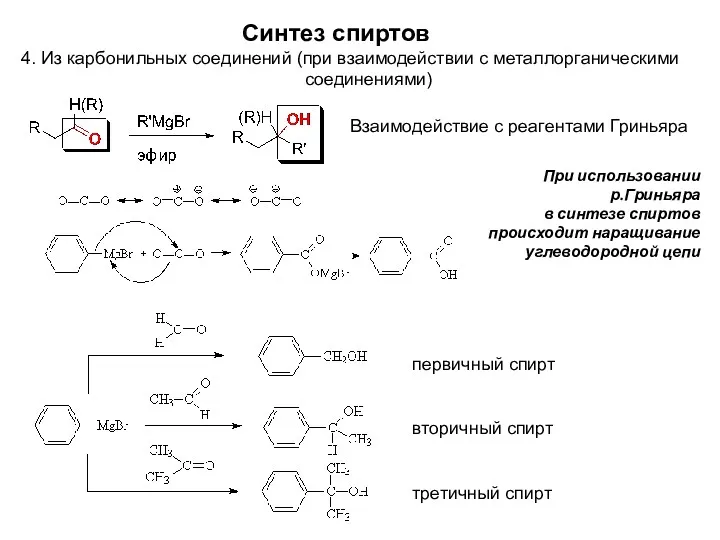
- 9. При использовании р.Гриньяра в синтезе спиртов происходит наращивание углеводородной цепи Синтез спиртов 4. Из карбонильных соединений
- 10. окись этилена Первичные спирты можно синтезировать, используя окись пропилена
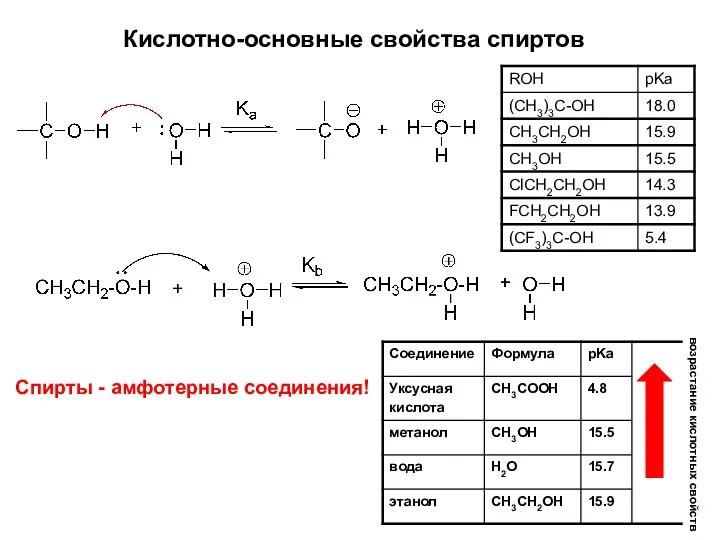
- 11. Кислотно-основные свойства спиртов возрастание кислотных свойств Спирты - амфотерные соединения!
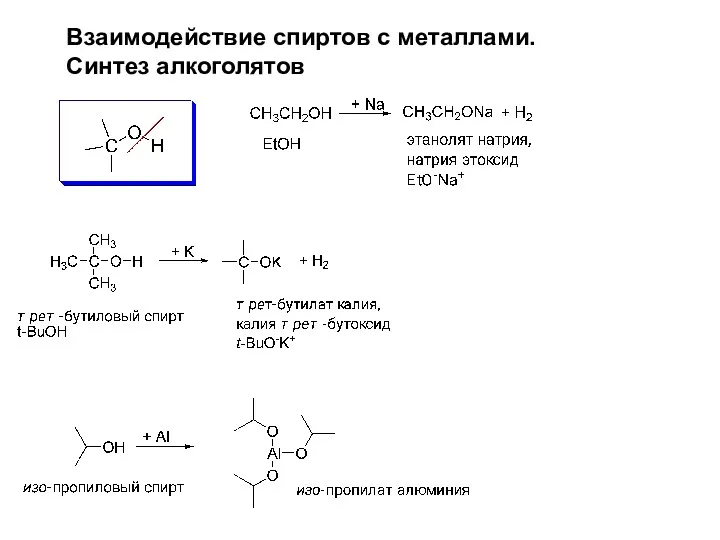
- 12. Взаимодействие спиртов с металлами. Синтез алкоголятов
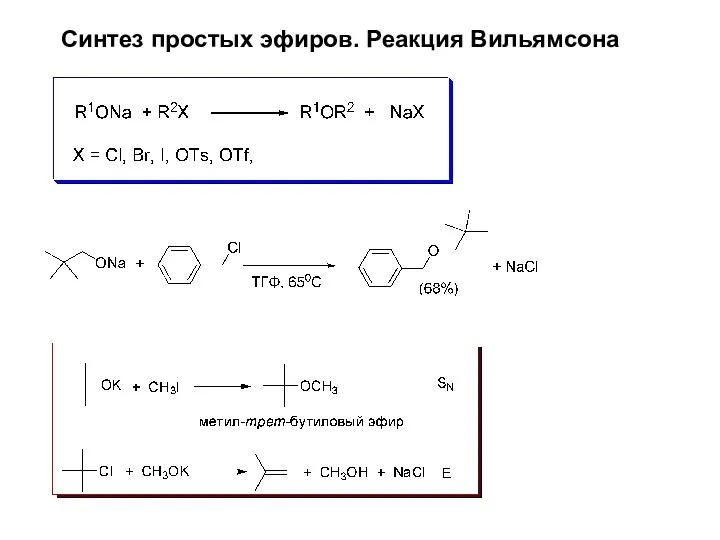
- 13. Синтез простых эфиров. Реакция Вильямсона
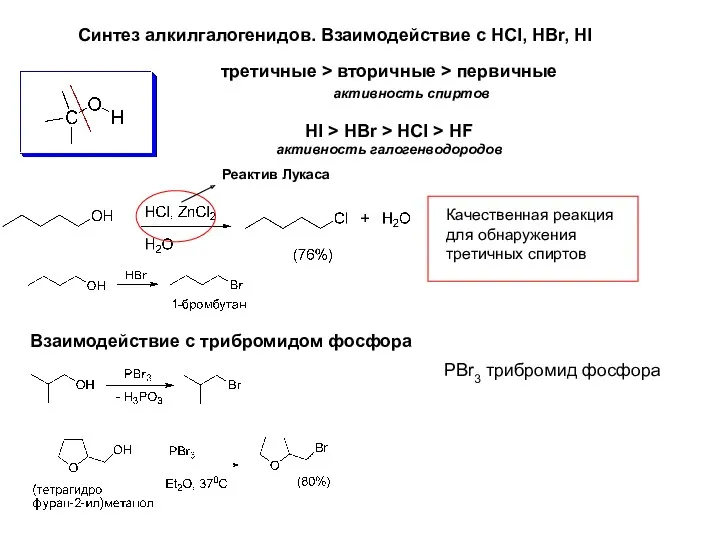
- 14. Синтез алкилгалогенидов. Взаимодействие с HCl, HBr, HI Реактив Лукаса Качественная реакция для обнаружения третичных спиртов третичные
- 15. Синтез алкилгалогенидов. Взаимодействие с тионил хлоридом SOCl2 тионил хлорид
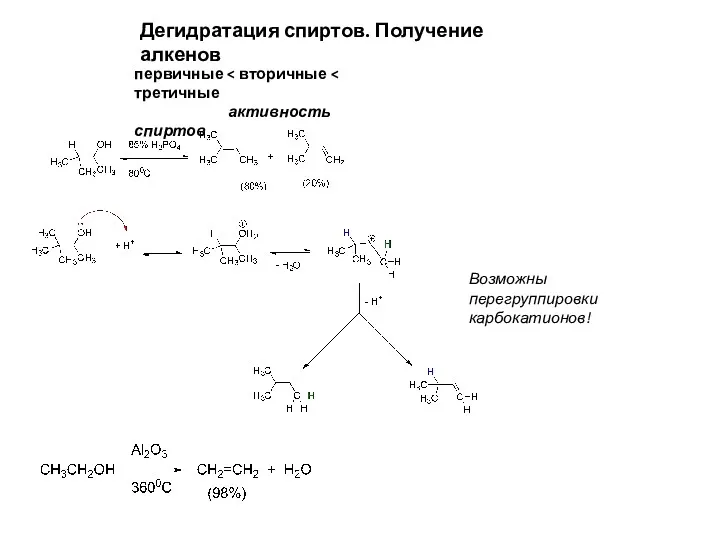
- 16. Дегидратация спиртов. Получение алкенов первичные активность спиртов Возможны перегруппировки карбокатионов!
- 17. Межмолекулярная дегидратация спиртов. Получение простых эфиров
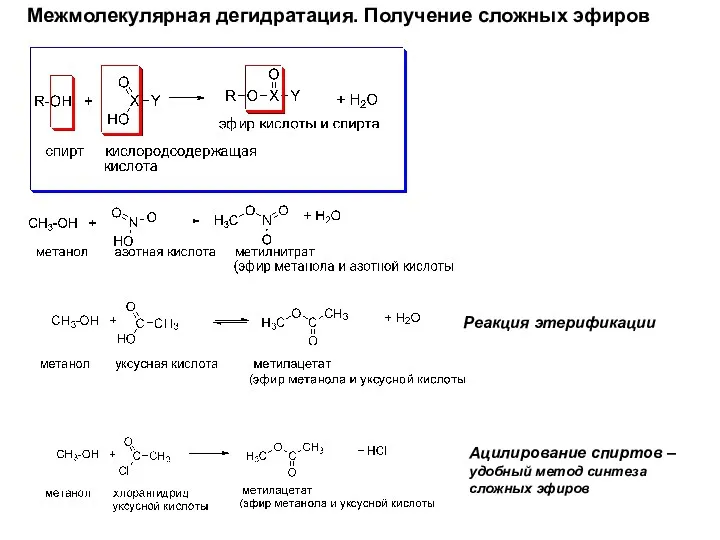
- 18. Межмолекулярная дегидратация. Получение сложных эфиров Реакция этерификации Ацилирование спиртов – удобный метод синтеза сложных эфиров
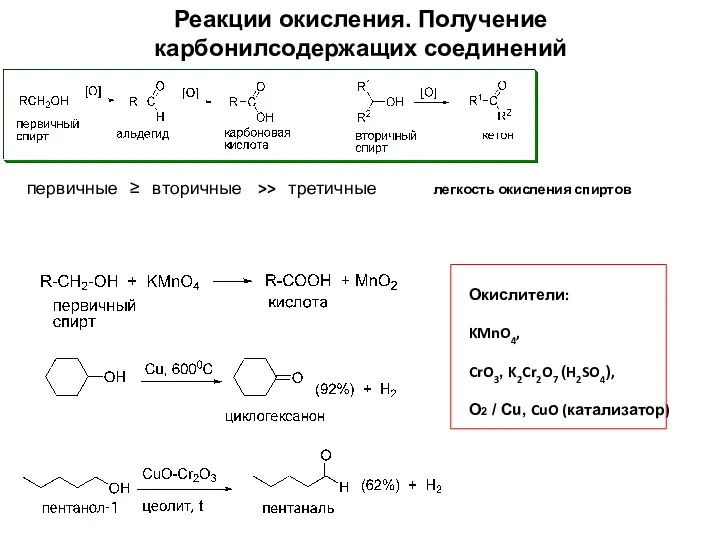
- 19. Реакции окисления. Получение карбонилсодержащих соединений Окислители: KMnO4, CrO3, K2Cr2O7 (H2SO4), О2 / Сu, CuO (катализатор) первичные
- 21. Скачать презентацию





 Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення
Хімічний зв’язок. Ковалентний, йонний, металічний, водневий зв’язки, механізми їх утворення Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии
Анализ качества неорганических лекарственных средств количественно определяемых методами редоксиметрии Физические свойства минералов
Физические свойства минералов Химия элементов VIA группы
Химия элементов VIA группы Физические и химические явления
Физические и химические явления Методы контроля и анализа веществ
Методы контроля и анализа веществ Кремний, его физические и химические свойства
Кремний, его физические и химические свойства Синтез и химические модификации индиго
Синтез и химические модификации индиго Инертные газы
Инертные газы Гетероциклдік қосылыстар
Гетероциклдік қосылыстар Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ
Окислительно-восстановительные реакции. Основные закономерности окисления различных классов органических веществ Признаки химических реакций
Признаки химических реакций Товары из пластмасс. Система маркировки пластика
Товары из пластмасс. Система маркировки пластика Повторение. Ионные уравнения реакции
Повторение. Ионные уравнения реакции Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія
Вcтуп до курсу Класифікації отрут і отруєнь. Токсикометрія Адсорбция. Разделение однородных и неоднородных смесей
Адсорбция. Разделение однородных и неоднородных смесей Техника безопасности на уроках химии
Техника безопасности на уроках химии Кислоты. Состав кислот
Кислоты. Состав кислот Поликонденсация. Фенолформальдегидные смолы
Поликонденсация. Фенолформальдегидные смолы Методы пробоотбора воздуха. Лекция 2
Методы пробоотбора воздуха. Лекция 2 Химическая промышленность
Химическая промышленность Морские льды. Их классификация и закономерности движения
Морские льды. Их классификация и закономерности движения Начала органической химии
Начала органической химии Электроотрицательность химических элементов
Электроотрицательность химических элементов Молекулярные и немолекулярные вещества
Молекулярные и немолекулярные вещества Классификация химических реакций в органической и неорганической химии
Классификация химических реакций в органической и неорганической химии Алюминий
Алюминий Органическая химия
Органическая химия