Слайд 2
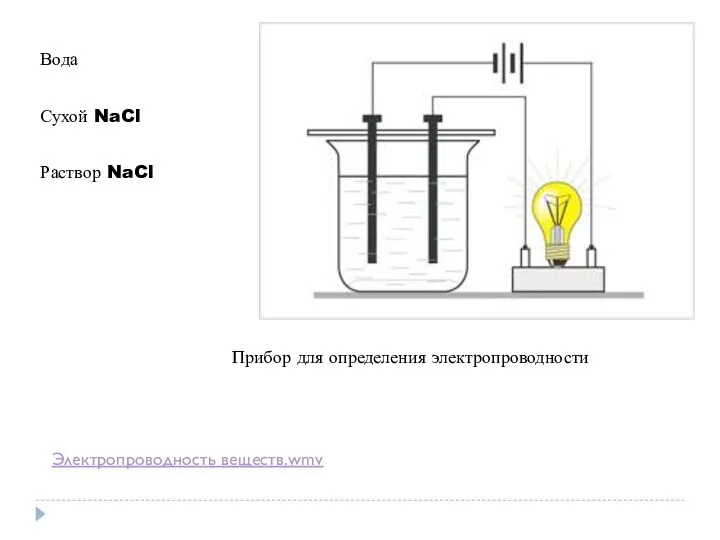
Прибор для определения электропроводности
Вода
Сухой NaCl
Раствор NaCl
Электропроводность веществ.wmv
Слайд 3
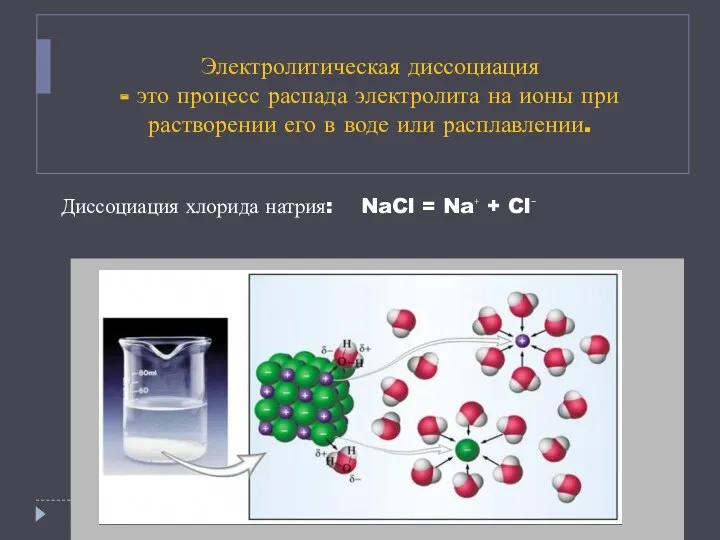
Электролитическая диссоциация
- это процесс распада электролита на ионы при растворении его
в воде или расплавлении.
Диссоциация хлорида натрия: NaCl = Na⁺ + Cl⁻
Слайд 4
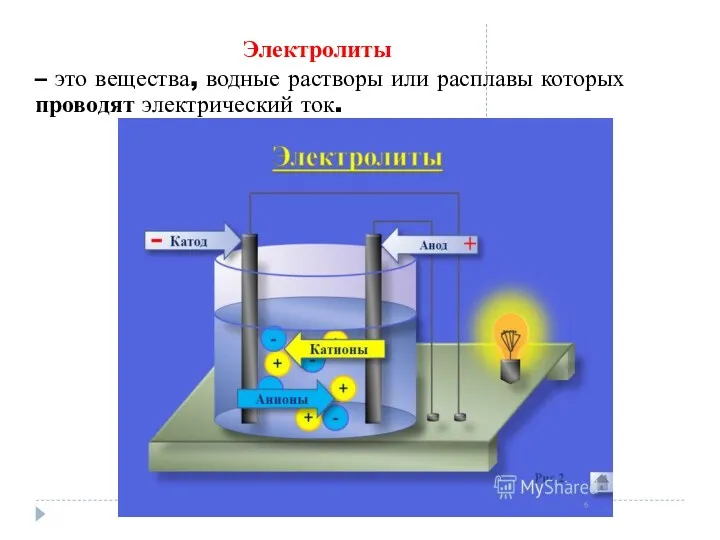
Электролиты
– это вещества, водные растворы или расплавы которых проводят электрический ток.
Слайд 5
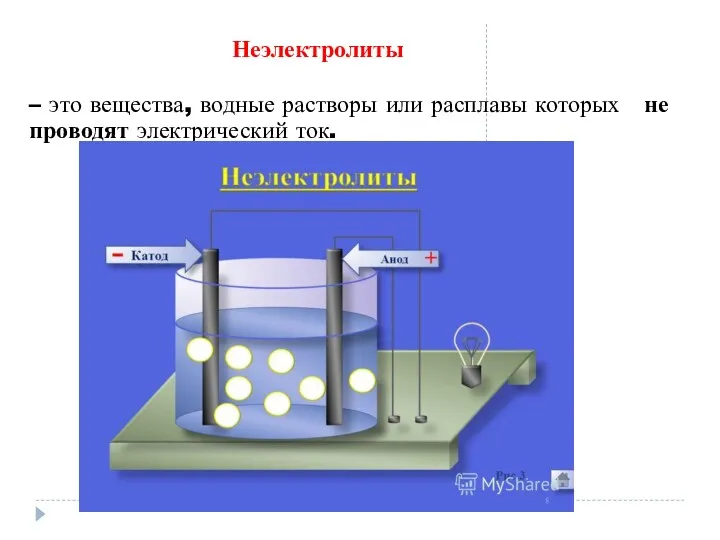
Неэлектролиты
– это вещества, водные растворы или расплавы которых не проводят электрический
ток.
Слайд 6
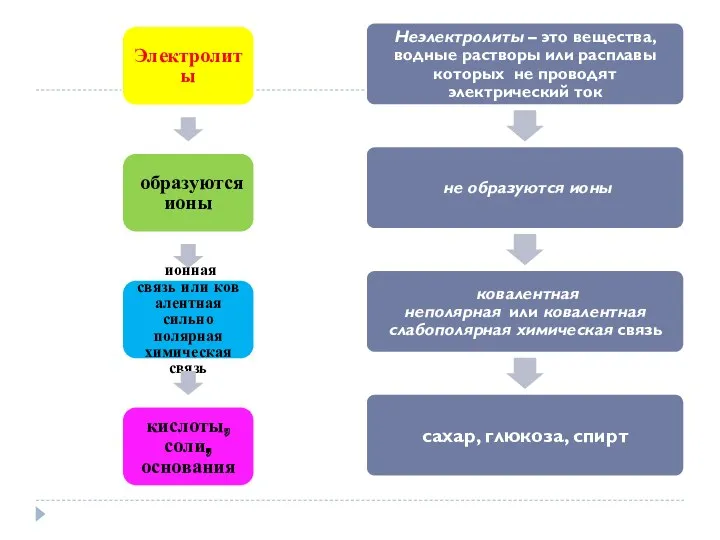
Электролиты
образуются ионы
ионная связь или ковалентная сильно полярная химическая связь
кислоты, соли, основания
Слайд 7
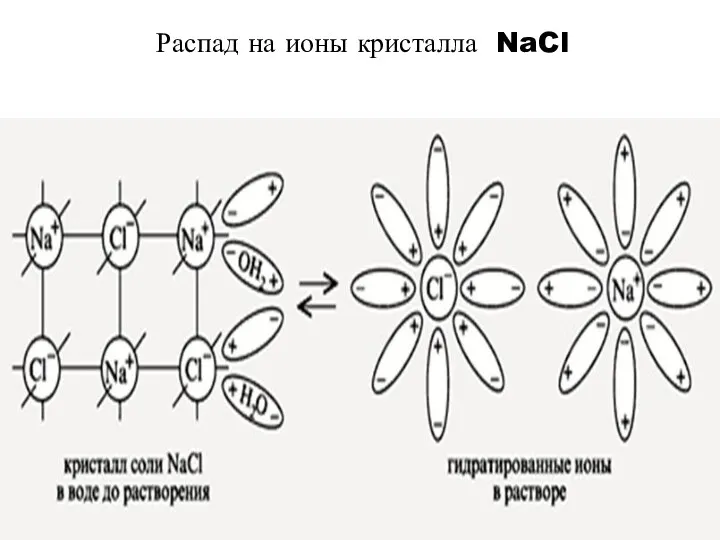
Распад на ионы кристалла NaCl
Слайд 8

Диссоциация кислот
Кислотами называются электролиты, при диссоциации которых в качестве катионов образуются только
катионы водорода (H+).
HCl ↔ H+ + Cl-
HNO3 ↔ H+ + NO3-
H2SO4 ↔ 2Н+ + SО2-4
Н3РО4 ↔ 3Н+ + PОЗ-4
Слайд 9

Диссоциация оснований (щелочей)
Основаниями называются электролиты, при диссоциации которых в качестве анионов образуются
только гидроксид-ионы (OH -).
KOH ↔ K+ + OH-
NH4OH ↔ NH4+ + OH-
Ba(ОН)2 ↔ Ba2++ 2OH-
Слайд 10

Диссоциация солей
Солями называются электролиты, при диссоциации которых образуются катионы металлов, а также катион
аммония (NH4+) и анионы кислотных остатков.
(NH4)2SO4 ↔ 2NH₄++ SO₄2-;
Na3PO4 ↔ 3Na+ + PO₄3-









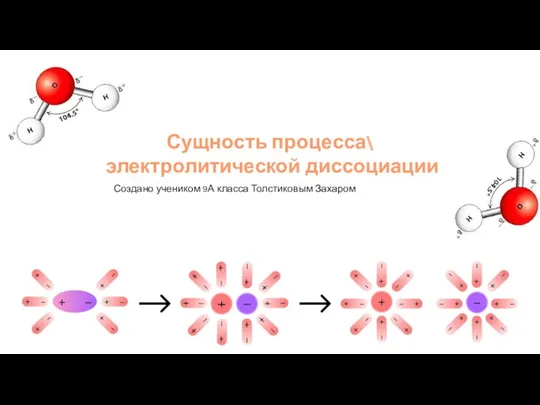 Сущность процесса электролитической диссоциации
Сущность процесса электролитической диссоциации Типы химических реакций. Тепловой эффект (11 класс)
Типы химических реакций. Тепловой эффект (11 класс) Азотсодержащие гетероциклические соединения
Азотсодержащие гетероциклические соединения Crystal defects
Crystal defects Классификация минералов по химическому принципу. Кварц, магнетит
Классификация минералов по химическому принципу. Кварц, магнетит Інгібіювання та регуляція ензимів
Інгібіювання та регуляція ензимів Аммиак. Состав вещества
Аммиак. Состав вещества Le trasformazioni fisiche della materia. Tema 3
Le trasformazioni fisiche della materia. Tema 3 Введение в химию
Введение в химию Обмен нуклеотидов
Обмен нуклеотидов Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором
Основні технологічні процеси очистки води. Знезараження води. Знезараження води хлором Возраст в геологии
Возраст в геологии Соединения щелочных металлов
Соединения щелочных металлов Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання
Оксиди: поняття, склад і назви, фізичні властивості, поширеність у природі, використання Аммиак. Образование молекулы аммиака
Аммиак. Образование молекулы аммиака Химическая связь. (Лекция 4, 5)
Химическая связь. (Лекция 4, 5) Гетерофункциональные производные бензольного ряда как лекарственные средства
Гетерофункциональные производные бензольного ряда как лекарственные средства Кислородные соединения азота
Кислородные соединения азота Закон сохранения массы веществ. Химические уравнения
Закон сохранения массы веществ. Химические уравнения Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Предельные углеводороды
Предельные углеводороды Теория электролитической диссоциации (ТЭД)
Теория электролитической диссоциации (ТЭД) Массообменные процессы
Массообменные процессы Снежинки. Рождение снежинки
Снежинки. Рождение снежинки Аномальные свойства воды
Аномальные свойства воды Алмастырылмайтын аминқышқылды алу биотехнологиясы
Алмастырылмайтын аминқышқылды алу биотехнологиясы Промежуточные фазы в металлических сплавах
Промежуточные фазы в металлических сплавах Моющие и чистящие средства
Моющие и чистящие средства