Жил когда-то на Востоке человек, который разводил верблюдов. Всю жизнь он
работал, а когда состарился, то позвал к себе сыновей и сказал:
«Дети мои! Я стал стар и немощен и скоро умру. После моей смерти разделите оставшихся верблюдов так, как я вам скажу. Ты, старший сын, работал больше всех — возьми себе половину верблюдов. Ты, средний сын, только начал мне помогать — возьми себе третью часть. А ты, младший, возьми девятую часть».
Прошло время, и старик умер. Тогда сыновья решили разделить наследство так, как завещал им отец. Они выгнали стадо на большое поле, пересчитали, и оказалось, что в стаде всего семнадцать верблюдов. И нельзя было разделить их ни на 2, ни на 3, ни на 9!
В это время ехал мимо путник на своём верблюде. Услышав крик и спор, он спросил: «Что случилось?»
И сыновья рассказали о своей беде.
Путник слез с верблюда, пустил его в стадо и сказал: «А теперь разделите верблюдов, как велел отец».
И так как верблюдов стало 18, то старший сын взял себе половину, то есть 9, средний — треть, то есть 6 верблюдов, а младший девятую часть, то есть двух верблюдов.
И когда они разделили таким образом стадо, в поле остался ещё один верблюд, потому что 9, 6 и 2 это и есть 17 верблюдов. А путник же сел на своего верблюда и поехал дальше.
Притча о верблюдах




![V х.р. Природа р в-в [С]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/296773/slide-6.jpg)


![V х.р. Природа р в-в t° [С]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/296773/slide-9.jpg)

![V х.р. Природа р в-в kat t [С] ◦](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/296773/slide-11.jpg)
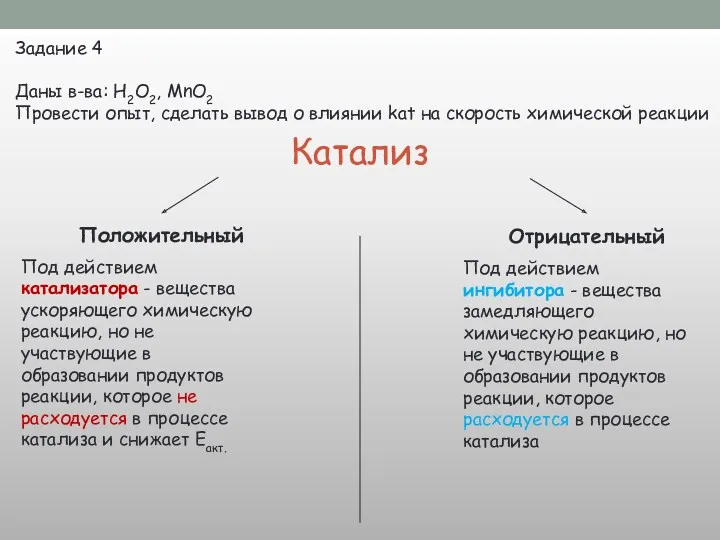

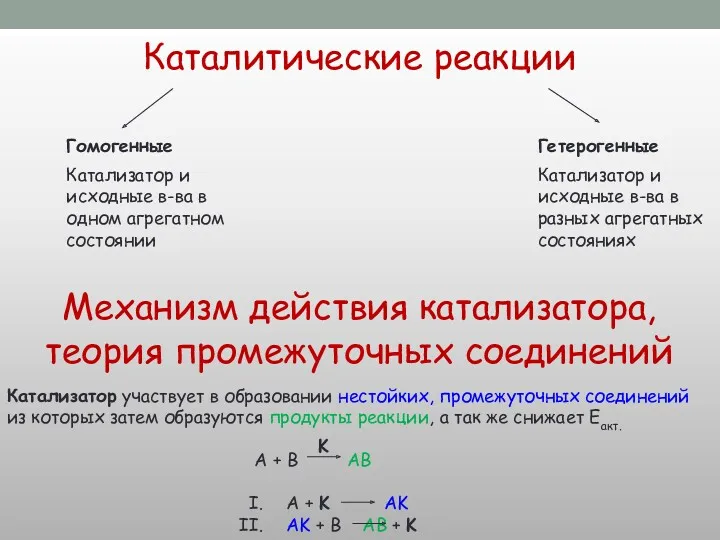


![V х.р. Природа р в-в kat t° S [С]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/296773/slide-17.jpg)





 Чистые вещества и смеси
Чистые вещества и смеси Вода-растворитель. Работа воды в природе
Вода-растворитель. Работа воды в природе Щелочные металлы
Щелочные металлы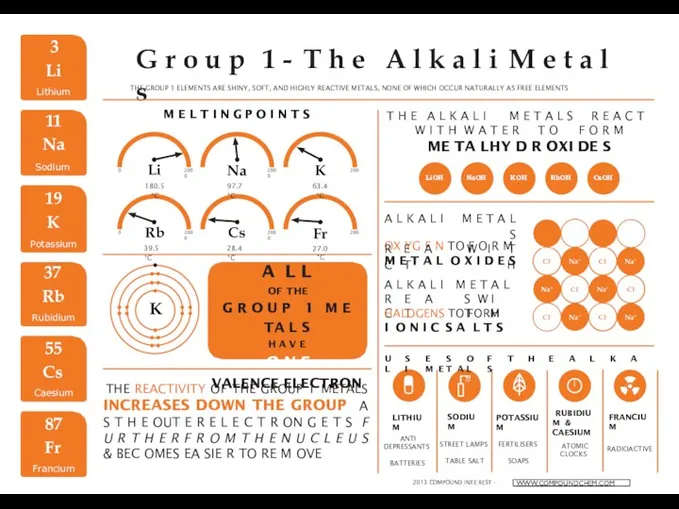 The alkali metals
The alkali metals Предмет органической химии
Предмет органической химии Приготування розчинів
Приготування розчинів Периодическая система Д.И. Менделеева
Периодическая система Д.И. Менделеева Энергоресурсы и их использование
Энергоресурсы и их использование Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології
Використання радіоактивних ізотопів, як індикаторів у тваринництві і археології Химические соединения в организме человека
Химические соединения в организме человека Углеводы. Моносахариды
Углеводы. Моносахариды Карбоновые кислоты. Нахождение в природе
Карбоновые кислоты. Нахождение в природе Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений
Электростатические взаимодействия, как фактор, определяющий структуру и реакционную способность органических соединений Химические формулы
Химические формулы Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Закон збереження маси речовини. Хімічні рівняння
Закон збереження маси речовини. Хімічні рівняння Методы составления уравнений окислительно-восстановительных реакций. Лекция №20
Методы составления уравнений окислительно-восстановительных реакций. Лекция №20 История мыловарения. Моющее действие мыла
История мыловарения. Моющее действие мыла Чистые вещества и смеси
Чистые вещества и смеси Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции
Подготовка к ГИА. В3. Степень окисления химических элементов. Окислительно-восстановительные реакции Добування кисню
Добування кисню Основы теории смазывания и стандарты качества моторных масел
Основы теории смазывания и стандарты качества моторных масел Гидроксид аммония
Гидроксид аммония Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis
Structural revision of (+)-uprolide F diacetate confirmed by asymmetric total synthesis Кислород O2
Кислород O2 Химия и живопись
Химия и живопись Кислородные соединения азота
Кислородные соединения азота Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату